2023-10-20 阅读量:744
在忙碌紧张的现代生活中,过度进食障碍(overeating disorders,ODs),如神经性暴食症及贪食症等,正逐渐成为严重困扰人类社会的健康问题。患者通常会表现出对美味食物的强烈渴望,并且对合理饮食的控制能力变弱,最终导致对高能量和美味食物的过度偏好,并在短时间内摄入大量食物。
节食经历和精神压力是ODs发展的最主要的两个诱发因素,研究发现节食史联合压力应激会引起暴饮暴食行为。近年来关于饮食调节的研究逐渐成为热点,饮食调节被认为受到神经调控、受肠道微生物及其代谢物影响等。但关于暴饮暴食行为背后的完整神经代谢环路仍不清楚,更缺乏全面深入的解读。
2023 年 10 月 3 日,中国科学技术大学生命科学与医学部熊伟教授与上海精神卫生中心陈珏主任医师以及安徽医科大学李敏教授等合作,在 Cell Metabolism 发表标题为 Microbiota-gut-brain axis drives overeating disorders 的研究论文,揭示了节食经历联合压力应激导致肠道中益生菌及代谢物犬尿酸的减少,伴随肠迷走神经-孤束核-丘脑室旁核环路的过度兴奋,最终使得模型小鼠表现为对可口食物的过度偏好和暴饮暴食行为。

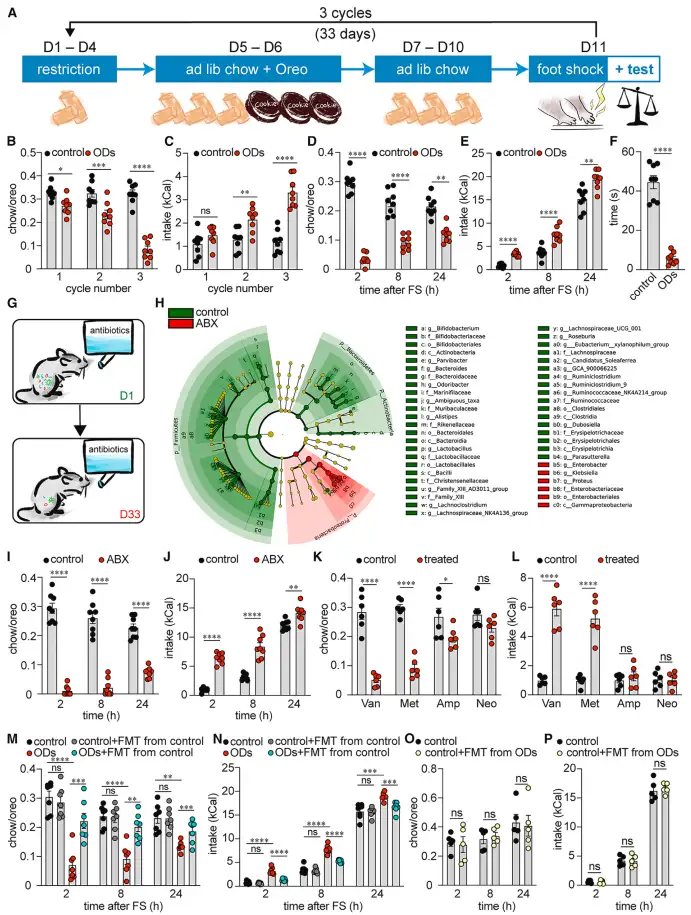
作者首先借助阶段性节食和相对温和的足底电击刺激联合获得了ODs模型小鼠。相较于健康对照小鼠,ODs小鼠对奥利奥饼干等可口和高热量的食物表现出了异常高的热情,并在相同的时间内,摄入显著更多的热量。这一动物模型成功模拟了人类ODs的核心症状。
接下来为了验证肠道微生物在ODs中的作用,作者使用四联抗生素清除了未进行过ODs建模小鼠肠道中的绝大多数微生物,发现这些小鼠出现了稳定且极端的过度进食行为。由此可知肠道微生物在进食调节中担任极为重要的“守卫”角色。将健康小鼠的粪便微生物定殖到小鼠肠道中,可以显著缓解ODs小鼠的暴饮暴食症状。而将ODs小鼠的粪便微生物反向定殖到健康小鼠体内,却无法复制过度进食的症状(图1)。这些结果表明,节食史联合压力应激导致的ODs很有可能是由于益生菌的减少而非有害微生物的增多引起的。
图1 ODs模型小鼠的建立及其与肠道微生物的联系
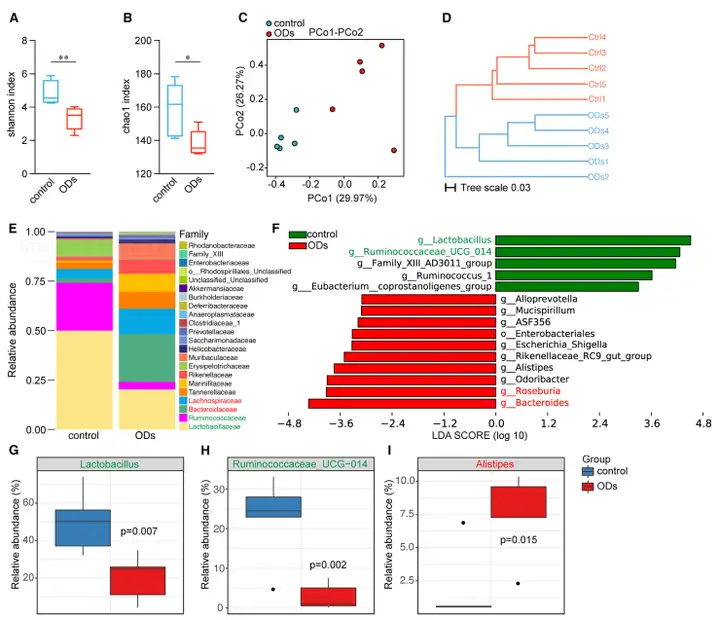
通过16srDNA测序,作者发现了ODs小鼠肠道中乳酸菌属和瘤胃菌属的微生物显著减少,而这些微生物是维持健康肠道环境必不可少的组成(图2)。
图2 ODs小鼠中的肠道菌群失调
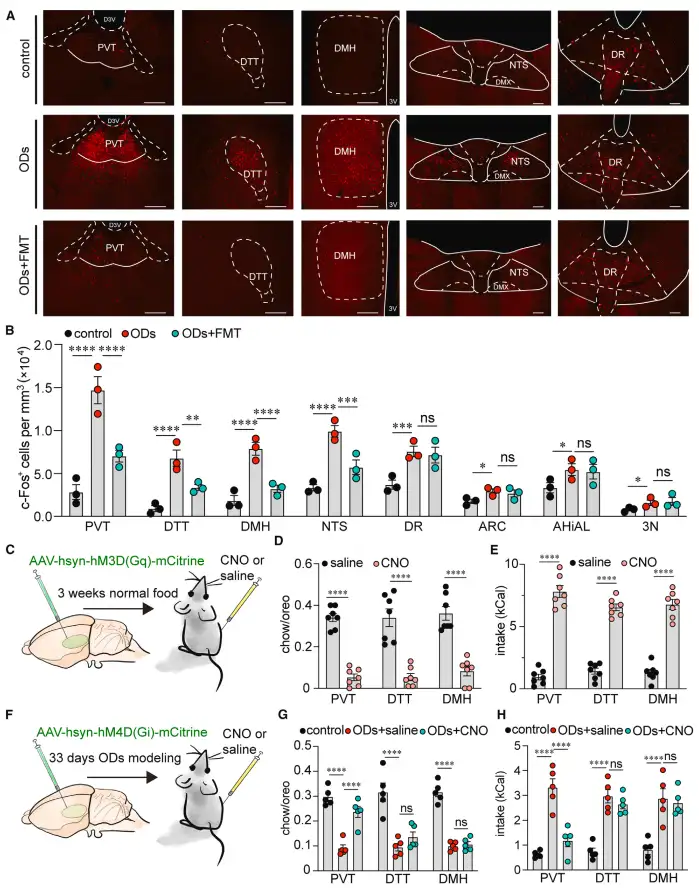
作者进一步对ODs小鼠进行全脑c-Fos染色并对潜在的候选核团进行化学遗传及光遗传操纵。当丘脑室旁核PVT被激活时,小鼠出现了明显的ODs症状;而当ODs建模小鼠的PVT被抑制时,其过度进食的症状得到了明显的缓解(图3)。
图3 筛选可能在ODs中发挥作用的核团
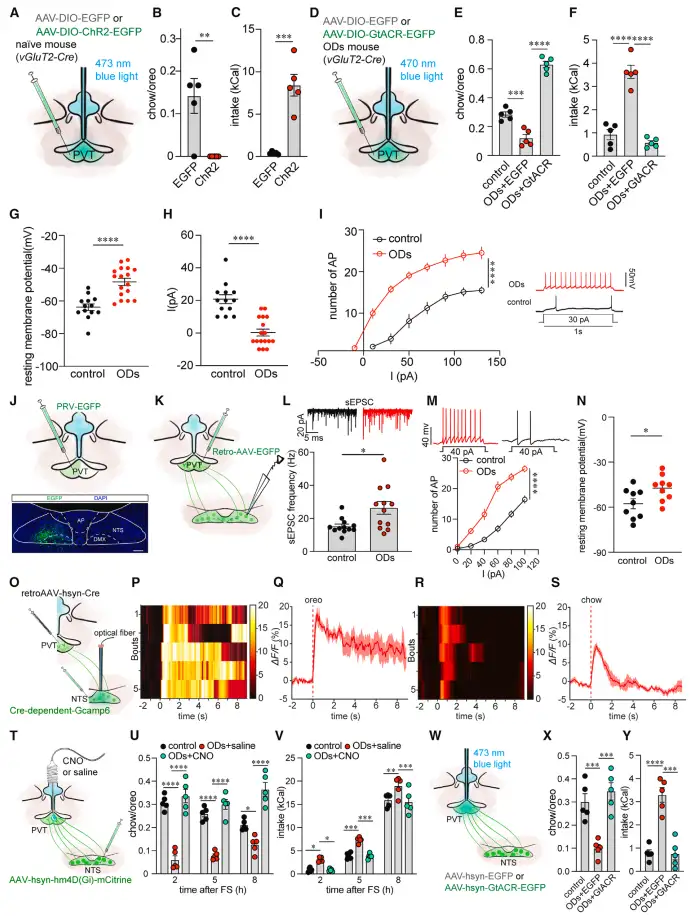
在起始于PVT的环路逆行示踪中,研究人员发现孤束核NTS直接投射到PVT,并通过全细胞膜片钳和在体光纤记录的方法在ODs小鼠的PVT和NTS中记录到了显著高于对照组的神经活动(图4),提示NTS-PVT环路在过度进食障碍中产生了过高的兴奋。
图4 NTS-PVT投射的过度兴奋介导了ODs症状
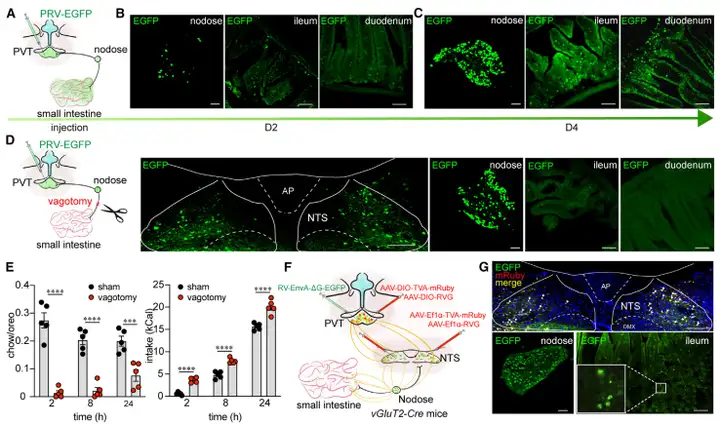
通过病毒追踪手段和迷走神经横断术,作者进一步找到了接收来自肠道信息的迷走神经(Vagus)-NTS-PVT投射环路,形成由肠道指导暴食行为的“通路”基础(图5)。
图5 肠-迷走神经-NTS-PVT环路的鉴定
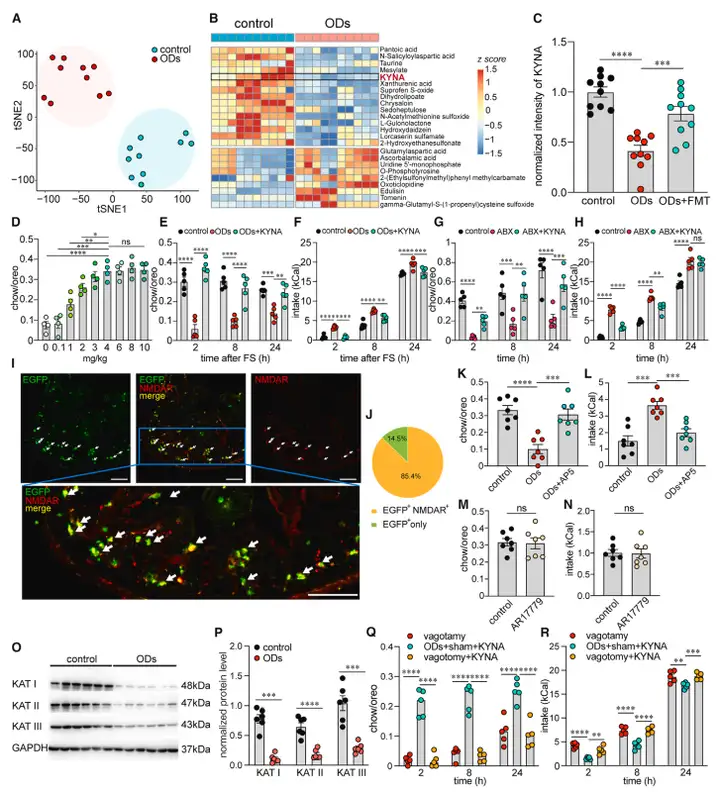
进一步的代谢组学研究发现在ODs小鼠的肠道众多代谢物中,犬尿酸(Kynurenic acid, KYNA)水平显著降低。补充肠道KYNA可以抑制Vagus-NTS-PVT环路的过度激活,从而缓解ODs小鼠过度进食症状(图6)。
图6 KYNA在ODs中的作用
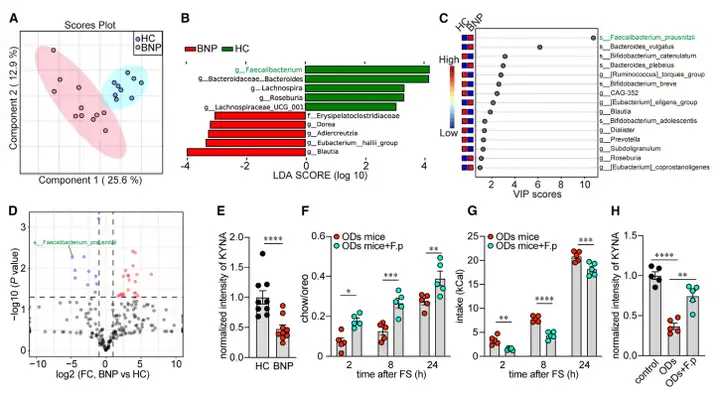
对临床神经性贪食症(Bulimia nervosa,BN)患者肠道中的微生物及代谢物进行分析,发现了同属于瘤胃菌属的Faecalibacterium_prausnitzii菌丰度远低于其在健康志愿者肠道中的水平。肠道KYNA水平在BN患者中也显著降低。随后,作者将Faecalibacterium_prausnitzii菌定殖到ODs小鼠肠道中后,发现小鼠的过度进食行为伴随着KYNA水平回升得到了明显改善(图7)。
图7 BN患者中肠道微生物和KYNA的变化
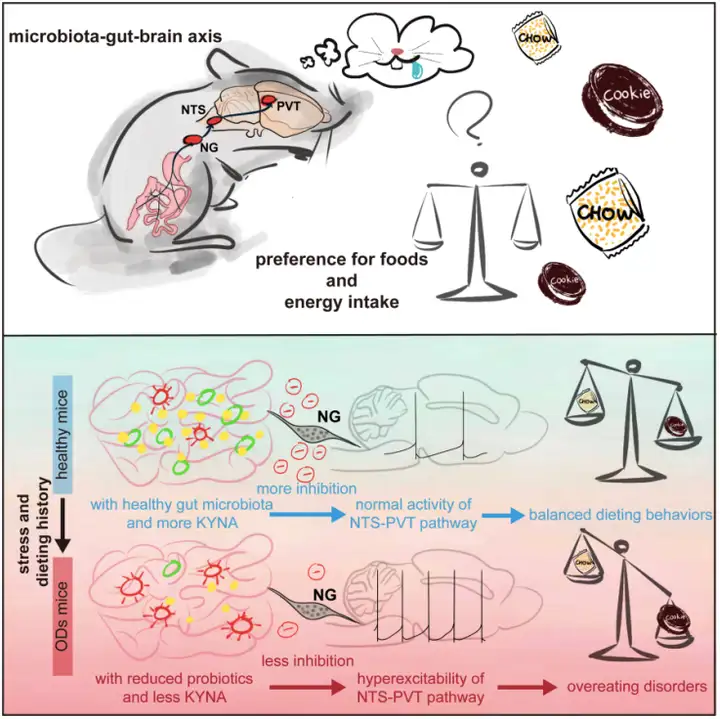
综上,这项工作通过对微生物检测、外周-中枢神经环路鉴定及肠道代谢物分析的多方位探究,阐明了介导过度进食障碍的微生物-肠-脑轴机制(图8),提示肠道微生物与中枢神经乃至行为之间相辅相成的重要关系,并为过度进食障碍相关疾病提供了潜在的治疗方向与策略。
图8 微生物-肠-脑轴介导过度进食障碍示意图

扫码下载原文
值得一提的是,熊伟教授课题组前期发展了一系列多尺度代谢组学新技术(PNAS, 2017; Anal Chem, 2019a,b;Nature Methods, 2021;Nature Machine Intelligence, 2023;Science Bulletin, 2023),发现了皮肤代谢物尿刊酸跨器官介导日光照射影响大脑学习记忆的神经环路机制,并阐明了其它多种代谢分子在神经环路及脑网络中的功能(Cell, 2018;Nature Communications, 2021;Cell Reports, 2020;Molecular Psychiatry, 2022;Nature Metabolism, 2022;Science Advances, 2023;Cell Metabolism, 2023)。此次解析肠道代谢物通过肠脑轴影响中枢摄食行为的工作,将其团队神经代谢领域的研究范畴进一步扩大到了外周肠道,为多角度多维度理解全身神经代谢网络与功能奠定了基础。
上述相关内容可参考熊伟教授课题组网站(http://xlab.ustc.edu.cn/)。
据悉,中国科学技术大学生命科学与医学部博士后范思佳、郭薇薇为本文共同第一作者,中国科学技术大学熊伟教授、上海精神卫生中心陈珏主任医师和安徽医科大学李敏教授为本文共同通讯作者。上海精神卫生中心彭素芳、中国科学技术大学尹浩与冯艾荣参与了合作研究。
熊伟教授课题组合照
通讯作者介绍:
熊伟,教授,博士生导师,中国科学技术大学生命科学学院,基金委国家杰出青年科学基金获得者,科技部“十三五”重点研发计划首席科学家,“万人计划”科技创新领军人才,科技部“中青年科技创新领军人才”。课题组长期从事神经生物学及神经化学领域的相关科学研究,研究兴趣与方向包括:
1. 开发新型神经化学研究技术,如单细胞代谢组学、单细胞器代谢组学、脑空间代谢组学等。
2. 依托单细胞和空间代谢组学检测技术,研究脑衰老及阿尔兹海默病、帕金森氏病等神经退行性疾病中小分子代谢组的变化及其分子机制,寻找相关的早期诊断标志物以及治疗方法。
3. 探究感知觉、情绪、认知的神经环路机制及其相关疾病,如癫痫、慢性痛、抑郁症、成瘾和耐受等,并开发相应的新型治疗药物和治疗方法。
4. 探索神经系统配体门控离子通道的调控机制,如甘氨酸受体和伽马氨基丁酸受体等。

本文使用的来自枢密科技的病毒产品,列表如下:


了解产品及服务
请扫码或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK