2023-07-17 阅读量:1190
急性疼痛会引起机体对实际或潜在组织损伤的保护性行为反应,但慢性疼痛会造成躯体感觉和情感方面的不愉快体验,使全球约20%的人口感到痛苦不堪。然而,疼痛慢性化(从急性疼痛转变为慢性疼痛)的神经生物学机制仍然不清楚。边缘系统被认为参与处理生理状态下的伤害性感受信息并通过显著的神经可塑性变化调节慢性疼痛。具体而言,背内侧前额叶皮层(dmPFC)在慢性疼痛期间起着至关重要的作用。研究表明,慢性背痛患者dmPFC活动与疼痛程度之间存在特定的相关性,在啮齿类动物慢性疼痛期间也观察到dmPFC的形态改变和兴奋性增加。然而,关于dmPFC如何调节疼痛慢性化的机制存在大量争议。在啮齿类动物中,dmPFC包括前边缘皮层(PrL)和前扣带回皮层前喙部(rACC)亚区。前人研究表明rACC在慢性疼痛中过度活跃,介导痛觉超敏反应和负面情绪调节。既往研究显示大鼠双侧PrL损伤缓解热刺激痛觉过敏,而激活PrL加重经历慢性炎症性疼痛大鼠的伤害性感受反应。然而,也有研究报道,在慢性疼痛中PrL第5层神经元的兴奋性受到抑制,PrL-PAG(中脑导水管周围灰质)连接减少。因此,PrL神经元在慢性疼痛中如何变化并促进慢性疼痛在不同的研究中有显著差异,这种差异可能源于dmPFC由不同的神经元亚群组成,这些亚群具有不同的形态、解剖、生理和功能特征,对疼痛调节有不同的贡献。
2022年12月13日,北京大学医学部基础医学院、神经科学研究所万有教授、伊鸣研究员在Cell Reports期刊在线发表题为“A nociceptive neuronal ensemble in the dorsomedial prefrontal cortex underlies pain chronicity”的研究论文,在本研究中,作者鉴定出dmPFC存在伤害感受神经元集群,其对伤害性刺激表现出显著的兴奋反应性,并促进慢性疼痛的发展。伤害感受dmPFC神经元与疼痛相关脑区如基底外侧杏仁核(BLA)和臂旁外侧核(LPB)紧密相连。持续化学遗传学激活这类伤害感受神经元集群在正常小鼠中诱导慢性疼痛样行为。相反,沉默伤害感受dmPFC神经元缓解慢性炎症性疼痛小鼠的疼痛超敏反应和焦虑。这些结果表明,在处理伤害感受信息和调节慢性疼痛方面存在特定的dmPFC神经元集群。

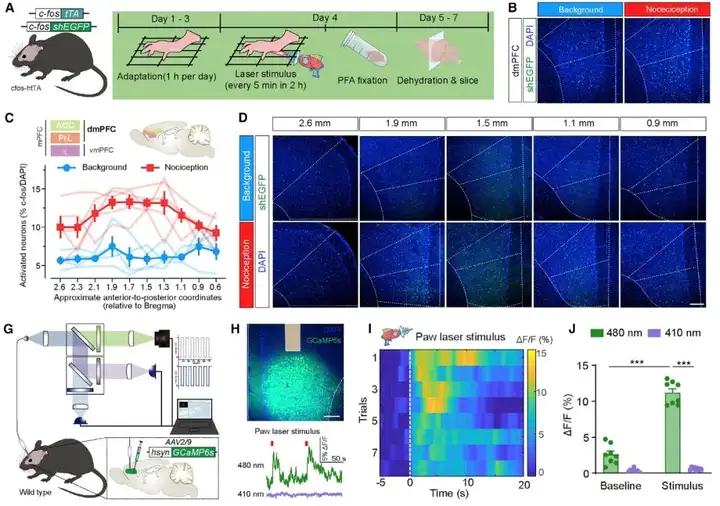
为研究大脑如何处理疼痛信号,研究人员使用cfos-htTA小鼠,该小鼠在cfos启动子控制下表达半衰期为2小时的绿色荧光蛋白(shEGFP)与四环素转录激活因子(tTA),以检测对小鼠后爪施加伤害性激光刺激后经典疼痛矩阵中神经元集群的激活模式。激光的功率足以诱导小鼠的伤害感受反应,但不会造成小鼠长期疼痛超敏。研究人员观察到dmPFC中激活的神经元显著增加,由于dmPFC由PrL和rACC组成,进一步探究激光激活神经元在dmPFC中沿着前后轴的分布模式。发现dmPFC中大多数cfos阳性神经元从表层到深层广泛分布。此外,响应伤害性激光刺激的大多数(90.3%±2.4%)cfos阳性神经元被发现与2型囊泡谷氨酸转运蛋白(VGlut2,谷氨酸能神经元标志物)共标记,而只有一小部分(9.7%±2.4%)与谷氨酸脱羧酶65和67(GAD65&67,GABA能神经元标志物)共标记。背景组、伤害感受组cfos标记dmPFC神经元中VGlut2、GAD65&67表达无明显差异。进一步确认dmPFC神经元活动响应于伤害性刺激的动态变化,研究人员利用在体纤维光度法监测Ca2+信号波动。右侧dmPFC注入AAV2/9-hSyn-GCaMP6s并埋置光纤,结果发现,480 nm蓝光激发的绿色荧光信号显著增强,表明dmPFC神经元被任一侧后爪的伤害性热刺激激活。此外,给予后爪机械刺激也观察到dmPFC神经元Ca2+信号明显升高。相比之下,dmPFC神经元在非伤害性触觉刺激后爪后活动很少。总的来说,这些结果揭示了dmPFC中有一类神经元集群被急性伤害性刺激显著激活。
图1. 急性后爪伤害性刺激激活dmPFC神经元集群
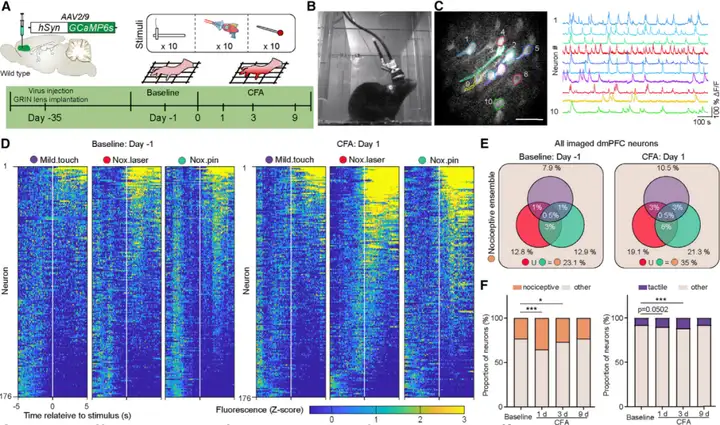
接下来,作者研究慢性疼痛条件下dmPFC在单个神经元水平对外部刺激的实时反应性,作者在野生型(WT)小鼠单侧dmPFC注射AAV2/9-hSyn-GCaMP6s,自由行为小鼠后爪注射CFA(弗氏完全佐剂)前后利用在体微型双光子显微镜记录Ca2+信号。在基线条件下,伤害性针刺和激光刺激分别诱导12.9%和12.8%的dmPFC神经元产生显著的Ca2+反应。作者将响应伤害性刺激的主要神经元视为dmPFC伤害感受集群。而在炎症性疼痛下,更大比例的dmPFC神经元响应伤害性刺激。后爪CFA注射后第1天(day 1),21.3%和19.1%的dmPFC神经元分别积极响应伤害性针刺和激光刺激。炎症性疼痛的后期(days 3-9)随着痛觉超敏的消失,激活dmPFC神经元比例逐渐降低。此外,dmPFC神经元对伤害性针刺和激光刺激的反应性在炎症性疼痛下显著增加。
图2. 双光子记录CFA诱导的炎症性疼痛中dmPFC神经元活动
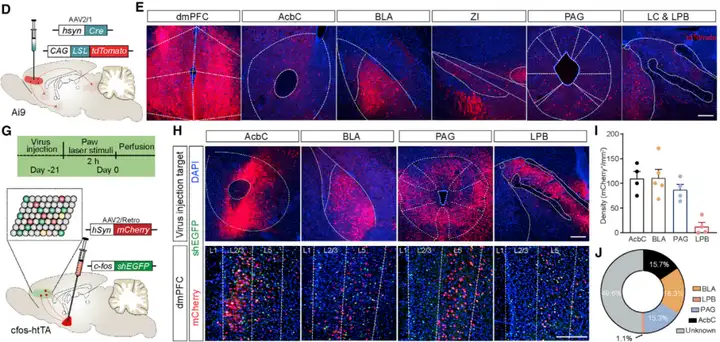
如果dmPFC中的伤害感受神经元集群促进疼痛的慢性化,研究人员假设这些神经元会表现出与疼痛调节密切相关的传出特性。作者借助顺行跨神经元载体AAV2/1-hSyn-Cre和Ai9小鼠追踪dmPFC神经元的下游投射,结果发现dmPFC神经元存在多个潜在下游靶点,包括岛叶皮层(IC)、伏隔核(AcbC)、BLA、PAG和LPB等。以往研究显示BLA、PAG、LPB和AcbC都参与处理疼痛的感觉或情绪方面。为进一步确认连接,作者在cfos-htTA转基因小鼠双侧BLA、PAG、LPB和AcbC分别注射逆行标记载体AAV2/Retro-hSyn-mCherry,病毒注射三周后,当dmPFC中的逆行追踪神经元表达mCherry时,小鼠接受爪激光刺激以标记伤害感受激活神经元(shEGFP+)。结果表示,研究人员观察到18.3%的dmPFC伤害感受神经元投射到BLA,15.7%投射到AcbC,15.3%投射到PAG,只有1.1%投射到LPB。此外,还发现投射到AcbC的dmPFC伤害感受神经元主要位于第2/3层,投射到PAG和LPB的神经元几乎全部来自dmPFC的第5层,而投射到BLA的神经元则来自dmPFC的第2/3层和第5层。整体而言,这些结果表明,dmPFC伤害感受神经元表现出参与疼痛处理的传出特征。
图3. dmPFC中伤害感受神经元集群的传出特征
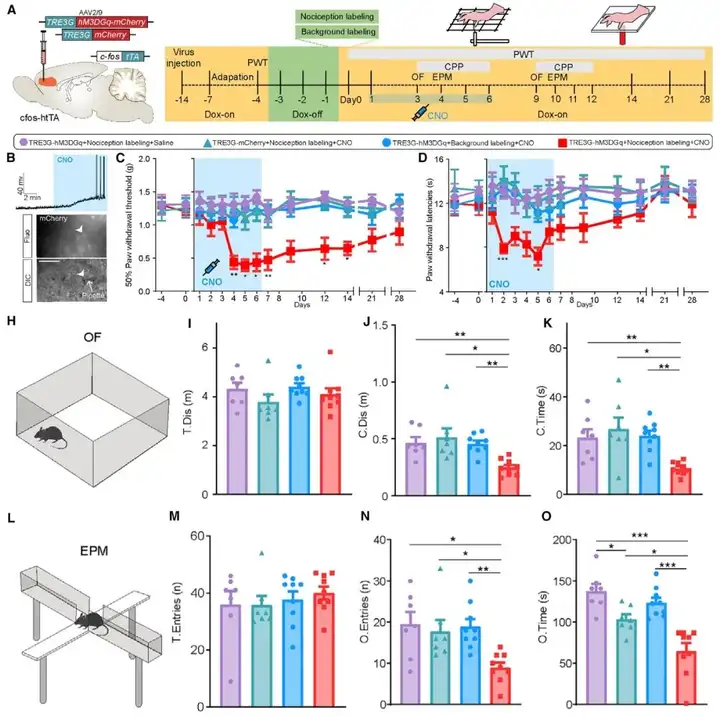
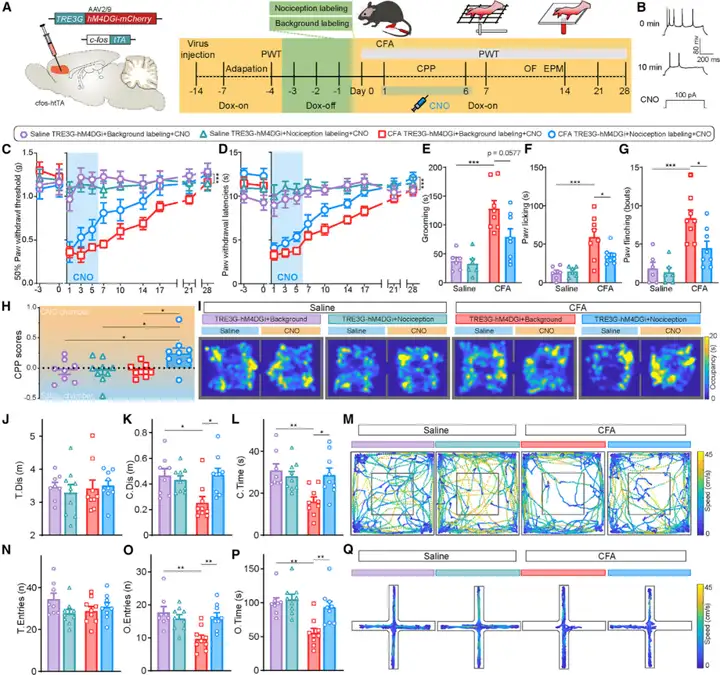
接下来,研究人员直接测试人工激活dmPFC的伤害感受激活神经元集群能否诱导慢性疼痛样行为,cfos-htTA转基因小鼠dmPFC注射AAV2/9-TRE3G-hM3DGq-mCherry,对照组注射AAV2/9-TRE3G-mCherry,dmPFC中伤害感受神经元集群被标记,并在注射CNO后被选择性激活。作者发现,连续6天(每天注射两次CNO,days 1-6)化学遗传学激活dmPFC中伤害感受激活神经元集群在正常小鼠中诱导显著的热刺激痛觉过敏和机械刺激痛觉超敏(甚至末次CNO注射后一周机械缩爪阈值PWT仍明显降低)。还记录了CNO给药期间小鼠的自发行为。结果显示CNO注射期间(days 4–5),dmPFC伤害感受神经元的激活显著增加条件位置偏好(CPP)实验中小鼠对镇痛剂量(1 mg·kg-1)吗一啡配对室的偏好。dmPFC伤害感受神经元被激活的小鼠焦虑水平明显增加(旷场实验OFT-day 9;高架十字迷宫EPM-day 10)。这些结果表明,dmPFC伤害感受神经元集群激活诱导的痛觉过敏和痛觉超敏是焦虑样行为的诱因。
图4. dmPFC伤害感受神经元的长期人工激活诱导慢性疼痛样行为
研究人员为确定dmPFC伤害感受神经元集群在慢性疼痛发展过程中的必要性,cfos-htTA小鼠双侧dmPFC注射AAV2/9-TRE3G-hM4DGi-mCherry,伤害感受激活的dmPFC神经元集群被标记,并在注射CNO后被抑制。长期化学遗传学抑制dmPFC中伤害感受激活神经元集群,改善CFA诱导的热痛觉过敏和机械痛觉超敏,但不影响生理盐水正常对照小鼠。同时,CFA注射后2天(day 3)化学遗传学抑制减少自发疼痛行为如理毛、舔爪等。进一步在CPP实验中证明dmPFC神经元集群抑制对自发性疼痛的镇痛作用,CFA注射后2-4天,炎症性疼痛的小鼠在CNO配对室呆的时间更长。化学遗传学抑制dmPFC神经元集群也显著减少小鼠疼痛相关焦虑样行为,即OFT中小鼠在中央区呆的时间更久,在中央区的移动距离更长;EPM中小鼠在开放臂中停留时间更多,进入开放臂的次数更多。综上所述,这些发现表明,抑制伤害感受dmPFC神经元集群减轻慢性炎症性疼痛。
图5. 长期抑制dmPFC伤害感受神经元缓解慢性炎症性疼痛
结论
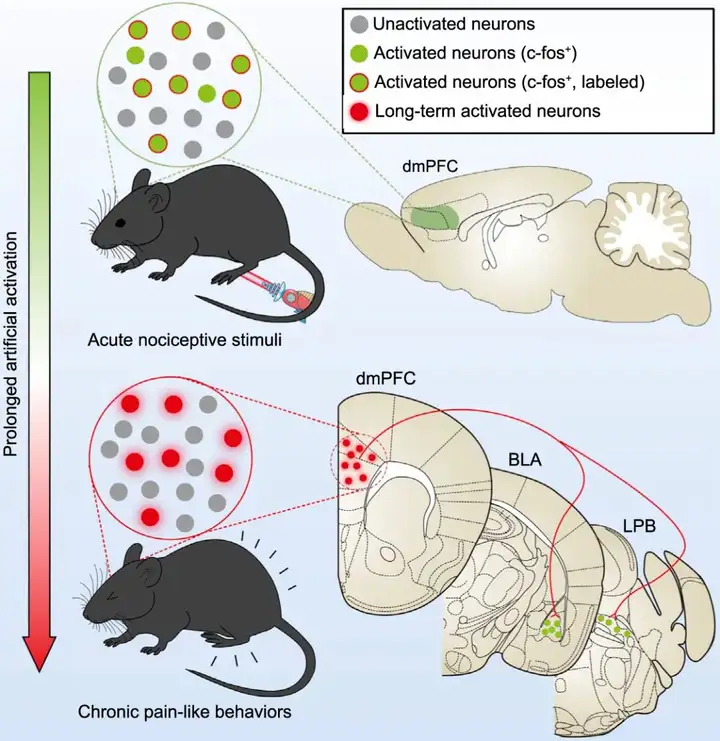
总的来说,本文发现dmPFC存在一类可特异性响应外周伤害性刺激的神经元集群,该类伤害感受神经元集群调节疼痛相关下游脑区BLA和LPB,介导慢性疼痛。
图6. dmPFC中伤害感受神经元集群调控慢性疼痛的示意图

扫码下载原文
通讯作者介绍:
万有,博士,教授,博士生导师,北京大学医学部基础医学院、北京大学神经科学研究所,科技部“973”项目首席科学家。
研究方向:
采用光遗传学、在体多通道记录与神经计算、胞外电生理、单细胞及脑片膜片钳、分子生物学、细胞生物学、形态学、行为药理学等多种方法,从分子—神经元—神经网络—整体不同层面,研究疼痛慢性化的学习记忆、情绪与认知及其调控机制。
1. 疼痛与镇痛的神经生物学机制,尤其是慢性痛的机制。
2. 针刺镇痛的神经生物学机制
伊鸣,研究员,博士,北京大学神经科学研究所认知神经科学实验室PI。
研究方向:记忆的精准操控与功能重建
学习与记忆是重要的认知功能。而病理性记忆是慢性痛、创伤后应激综合征、物质成瘾等多种神经系统疾病的共有特征。记忆痕迹由广泛分布在海马、新皮层等脑区的印迹细胞群编码并储存。伊鸣研究员实验室联合应用清醒动物在体电生理记录、光/化学遗传学、分子生物学、脑片膜片钳、行为学等多项先进技术,关注记忆与病理性记忆的细胞基础、记忆的精准操控与疾病状态下的记忆功能重建。记忆障碍是阿尔兹海默病、慢性痛、抑郁症等多种神经系统疾病中的常见表现。目前实验室的工作集中于应用药物学、神经调控与神经工程等技术,实现疾病状态下的记忆功能重建,为多种以记忆障碍为特征的疾病治疗提供新思路。

本文使用的来自枢密科技的病毒工具,列表如下:


了解产品及服务
请扫码或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK