2023-03-08 阅读量:30535
肠易激综合征(IBS)是一种以慢性内脏疼痛为特征的功能性胃肠道疾病,临床表现为腹痛和排便习惯改变,在人群中具有较高的发病率,病因复杂,治疗困难。越来越多的证据表明,与健康受试者相比,患有IBS的受试者更有可能经历创伤和心理压力,尤其是早期生活压力。早期生活压力可能会导致大脑功能和内脏对刺激敏感性的长期变化。新生儿母婴分离(NMD)是一种典型的早期生活压力应激模型,已被证明可诱导动物产生内脏疼痛行为。目前,关于内脏疼痛的大多数研究集中于探究外周神经系统和脊髓层面的分子机制,然而,专注于大脑的研究非常有限,大脑在调节内脏疼痛中的作用在很大程度上仍不清楚。但大脑作为高级中枢对痛觉的调控具有至关重要的作用,NMD引起的内脏疼痛可能从大脑回路的角度得到更好的解释。
外侧隔区(LS)通常分为LS背侧、LS中间和LS腹侧。众所周知,LS对于处理情绪信息和调节对压力的行为反应至关重要,并在恐惧、认知、成瘾、奖励、和其他神经疾病中起着重要作用,但在内脏疼痛中的作用尚不清楚。前人研究表明内脏的伤害性刺激导致内脏疼痛并增强大鼠LS的局部脑血流,表明LS可能在内脏器官痛觉敏化中具有潜在的调节作用。此外,据报道LSV(外侧隔区腹侧)接收来自下丘脑室旁核(PVH)的神经投射。研究表明IBS的发生可能与下丘脑-垂体-肾上腺(HPA)轴的功能变化相关。内脏敏感性的增加是IBS的主要特点,并会导致HPA轴功能改变。作为HPA轴的一部分,PVH协调行为、神经内分泌和自主应激反应以应对各种生理和心理压力,包括疼痛行为。尽管据报道PVH在调控躯体疼痛中发挥了重要作用,它在内脏疼痛中的作用还不完全清楚。
越来越多的证据已经证实,中枢神经系统的敏感性在内脏疼痛的发展中起着重要作用,而神经通路的确切作用机制在很大程度上仍然未知。2022年8月19日,来自苏州大学医学院神经科学研究所徐广银教授团队在疼痛研究领域权威期刊Pain上以Research paper的形式发表了题为“A Paraventricular Hypothalamic Nucleus Input to Ventral of Lateral Septal Nucleus Controls Chronic Visceral Pain”的研究论文,在这项研究中,作者发现从下丘脑室旁核(PVH)到外侧隔区腹侧(LSV)的独特神经回路调节内脏疼痛。数据表明PVH CaMKIIα阳性神经元对LSV CaMKIIα阳性神经元的输入仅由结直肠扩张而非躯体刺激激活,应对内脏疼痛的LSV区域CaMKIIα阳性神经元活性在NMD后大大升高。病毒示踪实验进一步证实了PVH-LSVCaMKIIα+投射途径。光遗传学抑制PVH CaMKIIα+对LSV CaMKIIα阳性神经元的输入抑制内脏疼痛;而选择性激活PVH-LSV CaMKIIα+投射诱发内脏疼痛。综上所述,这些发现表明PVH-LSV CaMKIIα+回路在调节内脏疼痛中的关键作用。本研究确定了从PVH到LSV的神经回路介导小鼠内脏疼痛。这一发现有望为IBS患者内脏疼痛的临床治疗提供新的治疗策略。

1.直结肠扩张刺激激活LSV脑区
MD后的乳鼠接受结直肠扩张(CRD)手术,并记录腹直肌电信号(EMG)数据。EMG数据证实6周龄成年小鼠成功诱导出内脏疼痛(分析EMG,统计腹外斜肌放电次数以评估内脏运动,即记录腹肌收缩来测量痛觉)。与CON小鼠比较,NMD小鼠的EMG曲线下面积(AUC,腹壁肌电活动形成的曲线下面积评估内脏敏感性)在CRD压力为20 mmHg时,没变化,而分别在40、60和80 mmHg时显著增加。研究人员下一步评估内脏疼痛对大脑的影响。结果显示重复CRD刺激后,c-fos表达急剧增加,尤其是在LSV中。此外,还发现相比于CON小鼠,NMD小鼠LSV中c-fos表达增加更明显。于是,作者进一步评估LSV在内脏痛觉敏化中的特异性,重复von Frey纤维细丝刺激后,CON和NMD小鼠的LSV区c-fos的表达量可忽略不计,且CON和NMD小鼠之间不存在显著差异。表明伤害性躯体刺激可以轻微但不特异性激活LSV。值得注意的是,与von Frey细丝刺激后相比,CRD刺激显著增加了LSV的c-fos表达。这些数据表明LSV主要被内脏而非躯体的伤害性刺激激活。
图1. CRD刺激后,LSV区c-fos的表达水平显著增加
2.内脏刺激显著增强LSV神经元的钙活性
研究人员为量化LSV神经元在内脏和躯体刺激后的生理活动,记录清醒行为小鼠LSV神经元在体生理钙信号的变化。LSV脑区立体定位注射AAV2/9-hSyn-GCaMP6f,光纤钙信号记录显示伤害性的CRD刺激在导致内脏疼痛时,并诱导CON和NMD小鼠LSV区Ca2+活性急剧增加。然而NMD小鼠的Ca2+活性显著高于CON小鼠。进一步评估LSV神经元对内脏刺激反应的特异性,结果表明,von Frey纤维没有引起LSV神经元Ca2+信号的显著波动,表明LSV神经元对躯体刺激不敏感。这些结果表明LSV主要由CRD诱发的内脏疼痛而非躯体刺激激活,与作者先前的c-fos表达结果一致。
图2. CRD刺激诱导LSV神经元钙信号的急剧增加
3.内脏疼痛主要激活LSV脑区CaMKIIα阳性神经元
研究人员为验证内脏刺激激活的LSV神经元的类型,进行免疫荧光。免疫染色结果显示,LSV区域的c-fos阳性细胞主要与Ca2+/钙调蛋白依赖蛋白激酶(CaMKIIα)共表达。LSV脑区CaMKIIα+c-fos占c-fos的比例为70.73%,CaMKIIα+c-fos占CaMKIIα的比例为61.29%。此外,作者进一步通过免疫染色确定LSV中CaMKIIα阳性神经元的百分比,发现CaMKIIα+NeuN占NeuN的比例为17.24%。表明LSV中CaMKIIα阳性神经元不是主要类型。作者进一步描述内脏刺激后LSV区域激活的神经元类型,记录在体Ca2+信号变化。LSV区注射AAV2/9-CaMKIIα-GCaMP6f和AAV2/9-VGAT1-GCaMP6m分别感染CaMKIIα阳性神经元和GABA能神经元,数据表明,CRD诱导CON和NMD小鼠LSV CaMKIIα阳性神经元Ca2+活性急剧增加,而相同水平CRD刺激下,NMD小鼠中Ca2+的活性显著高于CON小鼠。这些数据表明LSV中的CaMKIIα阳性神经元由内脏疼痛激活。
图3. LSV脑区CaMKIIα阳性神经元由内脏疼痛行为激活
4. 光遗传沉默LSV CaMKIIα阳性神经元减轻NMD小鼠CRD诱发的内脏疼痛,而LSV CaMKIIα阳性神经元的光遗传激活促进正常动物CRD诱发的内脏疼痛行为
为了进一步表征LSV CaMKIIα阳性神经元在内脏疼痛行为中的精确作用,研究人员利用光遗传学操纵这些神经元,通过CRD结合EMG记录评估内脏疼痛。结果显示光遗传沉默LSV CaMKIIα阳性神经元减轻NMD小鼠CRD诱发的内脏疼痛反应,而LSV CaMKIIα阳性神经元的光遗传激活促进CON小鼠适应性CRD诱发的内脏疼痛反应。这些结果表明LSV CaMKIIα阳性神经元可调节内脏疼痛行为。
图4. LSV脑区的CaMKIIα阳性神经元调节内脏疼痛行为
5.PVH-LSV的CaMKIIα阳性神经元投射调节内脏疼痛行为
为研究NMD小鼠LSV CaMKIIα阳性神经元的功能变化,研究人员进行环路追踪。利用逆行示踪病毒(AAV2/R-hSyn-EGFP)和免疫荧光染色,结果表明PVH CaMKIIα阳性神经元顺行投射到LSV区。进一步利用顺行示踪病毒AAV2/9-hSyn-EGFP、顺行跨单突触病毒系统AAV2/1-CaMKIIα-Cre与AAV2/9-EF1α-DIO-EYFP验证PVH-LSV通路,结果表明PVH区域CaMKIIα阳性神经元对LSV CaMKIIα阳性神经元具有潜在的调节作用。此外,作者下一步评估CRD刺激后PVH区c-fos的表达,结果表示CRD刺激后PVH区的c-fos表达急剧增加。NMD小鼠的c-fos表达水平显著高于CON小鼠。进一步利用免疫荧光染色,结果表明c-fos主要与CaMKIIα共表达。PVH脑区CaMKIIα+c-fos占c-fos的比例为68.74%,CaMKIIα+c-fos占CaMKIIα的比例为72.08%。这些数据表明PVH区的CaMKIIα阳性神经元顺行投射到LSV CaMKIIα阳性神经元,而CRD刺激也可以激活PVH区CaMKIIα阳性神经元。
光纤钙记录发现CRD诱导CON和NMD小鼠中PVH区CaMKIIα阳性神经元Ca2+信号显著升高,而相同水平的CRD刺激下,NMD小鼠Ca2+活性显著高于CON小鼠。这些数据表明PVH区CaMKIIα阳性神经元被内脏刺激激活。进一步评估PVH CaMKIIα阳性神经元在内脏疼痛行为中的作用,内脏疼痛通过CRD结合EMG记录进行评估。数据显示光遗传沉默PVH CaMKIIα阳性神经元明显减轻NMD小鼠内脏疼痛行为,光遗传激活PVH CaMKIIα阳性神经元促进CON小鼠适应性内脏疼痛行为。综上所述,这些数据表明PVH CaMKIIα阳性神经元可以调节内脏疼痛行为。
最后,研究人员探究PVH-LSV通路在内脏疼痛行为中的作用,利用结合光遗传学与化学遗传学的双病毒操作,作者发现光遗传沉默投射到LSV的PVH CaMKIIα阳性神经元轴突末端,显著减轻了NMD小鼠的内脏疼痛,然而,这种效应被LSV CaMKIIα阳性神经元的CNO激活所阻断。这一结果表明PVH-LSV通路的激活是内脏疼痛行为所必需的。此外,研究人员进一步实验发现,光遗传激活投射到LSV的PVH CaMKIIα阳性神经元轴突末端,促进了CON小鼠的适应性内脏疼痛行为,而这种效应被LSV CaMKIIα阳性神经元的CNO抑制所消除。该结果进一步表明PVH-LSV通路的激活足以促进内脏疼痛行为。总的来说,这些数据表明PVH-LSV通路对于调节内脏疼痛行为是充分必要的。
图5. PVH-LSV环路剖析
图6. PVH-LSV的CaMKIIα阳性神经元投射调节内脏疼痛行为
本文通过NMD小鼠模型,结合CRD刺激、EMG记录、神经示踪、免疫荧光染色、光遗传学、化学遗传学、及光纤钙记录,发现PVH-LSV的CaMKIIα阳性神经元投射调节内脏疼痛行为。本研究的结果证明了PVH–LSV区域之间CaMKIIα阳性神经元连接在内脏痛觉过敏中的关键作用。靶向这一独特的途径可能为IBS患者内脏疼痛的临床治疗提供一种潜在而有力的方法。
苏州大学苏州医学院神经科学研究所的博士研究生李永昌与苏州大学附属儿童医院王谦教授为本文共同第一作者,苏州医学院神经科学研究所徐广银教授为本文独立通讯作者。该研究得到了国家自然科学基金(81920108016;31730040)的大力支持。
徐广银教授研究团队合影
通讯作者简介:
徐广银,江苏省特聘教授、江苏省双创人才、江苏省双创团队领军人才,现任苏州大学苏州医学院执行院长、苏州大学神经科学研究所课题组长、疼痛转化医学实验室主任。研究方向:1.疼痛转化医学;2.疼痛机制与镇痛原理;3.胃肠神经功能与疾病。徐广银教授长期从事慢性痛特别是功能性内脏疼痛的神经分子机制研究。


扫码下载原文
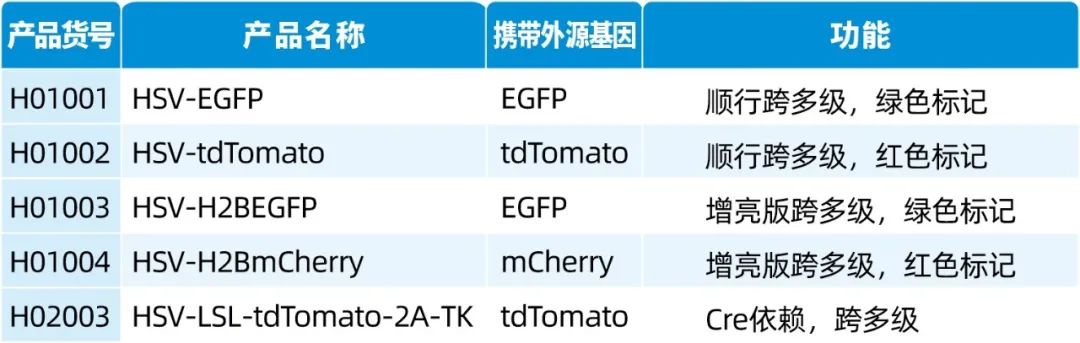
本文使用的来自枢密科技的病毒产品,列表如下:

相关推荐
我司可提供顺行跨单突触示踪13次方滴度1型-Cre/Flp的AAV病毒、(不跨突触)顺行/逆行示踪的9型、2/Retro血清型AAV病毒、顺行跨多突触示踪单纯疱疹病毒HSV,及病毒脑立体定位注射服务。相关产品列表如下:

了解产品及服务请扫码
或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK






