2023-02-21 阅读量:30331
阿片类药物(吗啡、芬太尼、美沙酮等)是临床上治疗疼痛最有效、使用最广泛的一类药物。值得关注的是,这类药物的长期使用引起的药物镇痛耐受严重限制了阿片类药物的临床应用,也是阿一片类药物上瘾和滥用的根本原因。大量基础和临床研究发现长期在固定环境中接受阿一片类药物治疗会导致阿一片镇痛耐受速度明显加快,这一现象被称为环境偶联的阿一片镇痛耐受(Associative opioid analgesic tolerance,AOAT),AOAT是阿一片类药物耐受的重要组成形式,然而目前介导AOAT的中枢神经环路尚不清楚。
2023年2月8日,中国科学技术大学生命科学与医学部熊伟教授课题组在Science Advances期刊在线发表了题为“Coordinated activity of a central pathway drives associative opioid analgesic tolerance”的研究论文。在这项工作中,研究人员通过小鼠成功建立了AOAT动物模型,结合光遗传、化学遗传、钙成像和脑片电生理等方法,明确了腹侧海马的谷氨酸能神经元→背内侧前额叶皮层的胆囊收缩素能神经元→基底外侧杏仁核的谷氨酸能神经元这条神经环路在AOAT中的重要作用。

Science Advances期刊同期还对该工作以“Pavlovian-conditioned opioid tolerance”为题进行了3页纸的焦点评论。国际上著名的《New Scientist》(新科学家)杂志也对该工作以“Newly found brain pathway could be key to reducing opioid addiction”进行了详细报道。

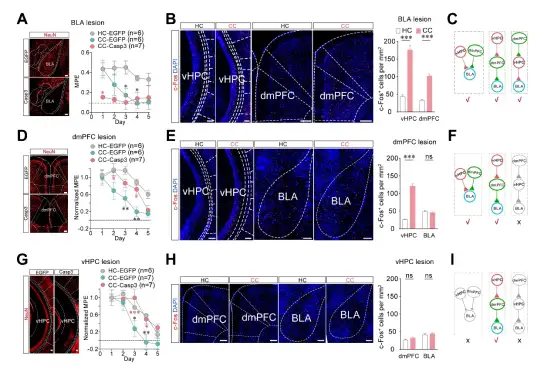
为了建立AOAT模型,作者首先分别在小鼠的饲养笼和与饲养笼环境完全不同的特殊环境中对小鼠连续腹腔注射吗啡,结果显示环境不会影响吗啡的镇痛作用,但是特殊环境中吗啡的耐受速度明显快于饲养笼中,从而成功建立AOAT模型。通过侧脑室和鞘内注射吗啡发现AOAT发生在脊髓上水平,而全脑c-fos染色发现吗啡与特定环境偶联后会导致腹侧海马(vHPC)、背内侧前额叶皮层(dmPFC)和基底外侧杏仁核(BLA)中的神经活动明显增加(图1)。
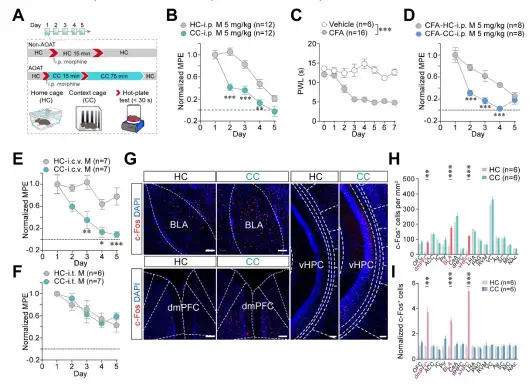
图1. AOAT关键核团鉴定。
接着,通过依赖taCasp3诱导神经元凋亡的方法特异性损毁了BLA、dmPFC和vHPC脑区。结果显示损毁BLA后吗啡的镇痛作用消失了,但是不影响vHPC和dmPFC中c-fos的变化;而损毁dmPFC和vHPC后抑制了AOAT的发展,并且损毁dmPFC抑制了AOAT诱导的BLA c-fos的增加,而损毁vHPC抑制了AOAT诱导的dmPFC和BLA c-fos的增加(图2)。以上结果说明,大脑可能是通过vHPC→dmPFC→BLA的三级环路投射调控AOAT的发展。
图2. vHPC、dmPFC和BLA参与调控AOAT。
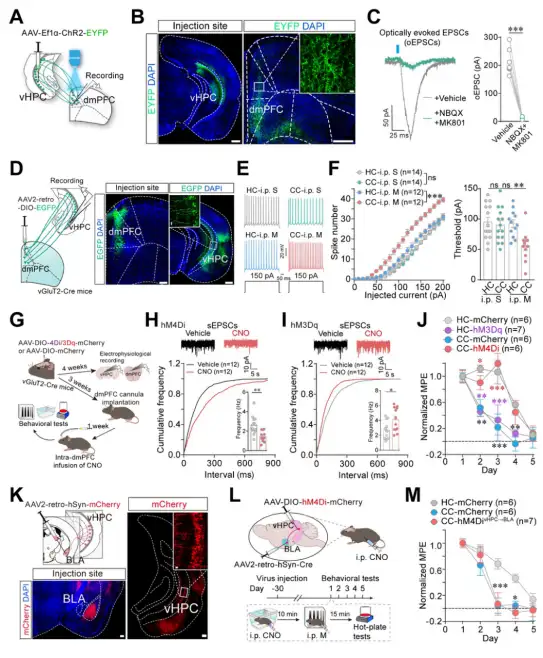
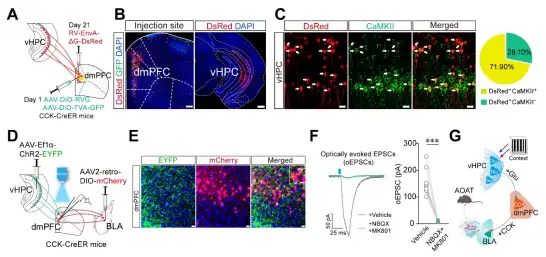
以前研究表明vHPC→dmPFC的投射神经元参与环境编码,所以作者首先验证了vHPC→dmPFC的投射在AOAT中的作用。通过光遗传和脑片电生理发现vHPC→dmPFC有谷氨酸能投射神经元,并且这些神经元的活性在AOAT中明显增加。化学遗传激活vHPC→dmPFC谷氨酸能神经元投射明显增加了吗啡耐受的速度,模拟了AOAT,化学遗传抑制vHPC→dmPFC谷氨酸能神经元投射抑制了AOAT的发展,而化学遗传抑制vHPC→BLA的投射不影响AOAT的发展(图3)。以上结果说明,vHPC→dmPFC谷氨酸能投射在AOAT中发挥重要作用。
图3. vHPC→dmPFC谷氨酸能投射神经元参与调控AOAT。
神经环路示踪显示dmPFC到BLA有神经元投射,化学遗传抑制dmPFC→BLA投射抑制了AOAT的发展,而化学遗传激活dmPFC→BLA投射增加了饲养笼中小鼠的吗啡耐受速度,模拟了AOAT。同时,钙成像实验结果显示在AOAT中dmPFC→BLA投射神经元的活性增加,而单纯的环境或吗一啡并不能增加dmPFC→BLA投射神经元的活性(图4)。以上结果说明,dmPFC→BLA投射在AOAT发展中发挥重要作用。
图4. dmPFC→BLA投射参与调控AOAT。
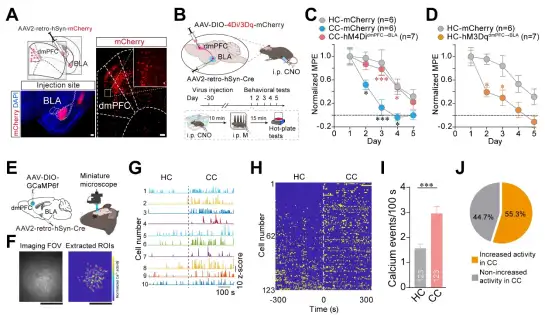
通过RNA测序,作者发现在dmPFC中抗阿片有关的基因胆囊收缩素(CCK)的mRNA表达水平很高,而CCK是脑内最有效的内源性抗阿片肽。通过转基因小鼠、RetroAAV逆行标记、AAV-EGFP顺行标记和RV逆行追踪,作者发现dmPFC的CCK能神经元投射到BLA的谷氨酸能神经元上,并且dmPFC→BLA的CCK能神经元的活性在AOAT中增加。化学遗传抑制dmPFC→BLA的CCK能神经元投射抑制了AOAT的发展,化学遗传激活dmPFC→BLA的CCK能神经元投射增加了饲养笼小鼠吗啡耐受的速度,模拟了AOAT(图5)。以上结果说明,dmPFC→BLA的CCK能投射神经元在AOAT中发挥重要作用。
图5. dmPFC→BLA的CCK能投射神经元参与调控AOAT。
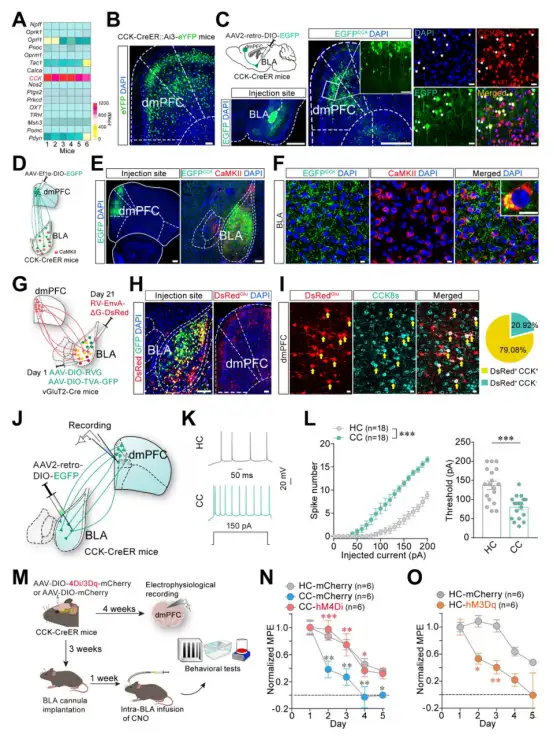
通过RV逆行示踪和免疫荧光染色,作者发现vHPC的谷氨酸能神经元投射到dmPFC的CCK能神经元上,接着通过光遗传、RetroAAV逆行标记和脑片电生理,作者进一步验证了vHPC的谷氨酸能神经元投射到dmPFC中投射到BLA的CCK能神经元上(图6)。以上结果说明存在GluvHPC→CCKdmPFC→GluBLA的环路参与调控AOAT。
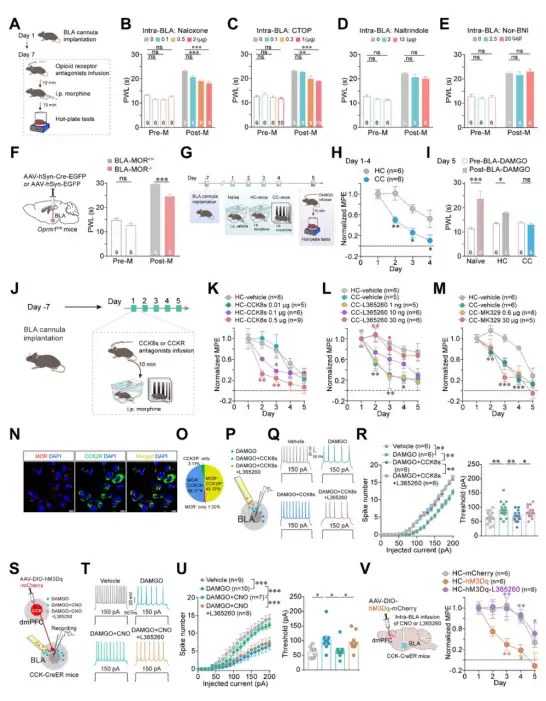
那么这条环路是如何导致吗一啡耐受速度加快的呢?为此,作者首先在BLA中注射了不同的阿片受体拮抗剂,发现BLA的μ-阿片受体在阿片镇痛中发挥重要作用,并且其作用随着AOAT的发展而降低。通过在BLA中注射CCK受体拮抗剂和激动剂,发现CCK2受体对于AOAT发展起作用。免疫荧光染色结果显示μ-阿片受体和CCK2受体在BLA中存在共定位。同时,脑片电生理结果表明激活CCK受体后会抑制μ-阿一片受体的作用(图7)。以上结果说明,在AOAT中dmPFC→BLA的CCK能投射神经元通过在BLA中释放CCK作用于CCK2受体,进而拮抗了μ-阿片受体的作用,最终导致耐受速度加快。
图7. BLA中CCK2受体拮抗了μ-阿一片受体的作用导致耐受速度加快
结论
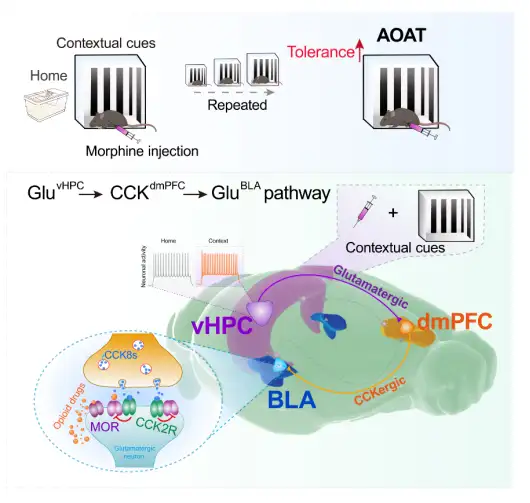
综上,结合光遗传、化学遗传、钙成像和脑片电生理等技术,解析了环境偶联阿一片耐受的神经环路及分子机制(图8),加深了我们对阿一片类药物耐受神经机制的认识,为临床上治疗阿一片耐受、成瘾和滥用提供了潜在的治疗靶点。
图8. 特定环境偶联阿一片耐受的神经环路示意图

扫码下载原文
中国科学技术大学博士后侯熠文和特任副研究员邹桂昌为论文的共同第一作者,熊伟教授为论文的唯.一通讯作者。本研究也得到了美国国立卫生研究院张黎研究员、中国科学技术大学杨煜鹏教授、北京生命科学研究所曹鹏研究员的大力帮助。该项工作得到了合肥微尺度物质科学国家研究中心、合肥综合性国家科学中心人工智能研究院的大力支持,以及科技部、基金委、中科院、教育部等部门的资助。
熊伟,教授,博士生导师,中国科学技术大学生命科学学院,基金委国家杰出青年科学基金获得者,科技部“十三五”重点研发计划首席科学家,“万人计划”科技创新领军人才,科技部“中青年科技创新领军人才”。课题组长期从事神经生物学及神经化学领域的相关科学研究,研究兴趣与方向包括:
1. 开发新型神经化学研究技术,如单细胞代谢组学、单细胞器代谢组学、脑空间代谢组学等。
2. 依托单细胞和空间代谢组学检测技术,研究脑衰老及阿尔兹海默病、帕金森氏病等神经退行性疾病中小分子代谢组的变化及其分子机制,寻找相关的早期诊断标志物以及治疗方法。
3. 探究感知觉、情绪、认知的神经环路机制及其相关疾病,如癫痫、慢性痛、抑郁症、成瘾和耐受等,并开发相应的新型治疗药物和治疗方法。
4. 探索神经系统配体门控离子通道的调控机制,如甘氨酸受体和伽马氨基丁.酸受体等。
本文使用的病毒产品均来自枢密科技,列表如下:


了解产品及服务请扫码
或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK