2022-04-02 阅读量:3606
编者按
基因疗法是通过非病毒或病毒载体将遗传物质引入靶细胞,通过改善缺陷基因来达到治疗或预防疾病的方法。基因治疗有体外治疗和体内治疗两种途径,体外基因治疗是使用患者身上获取的靶细胞,经过基因改造后再植入患者体内。体内基因治疗将遗传物质通过载体直接输送到患者的靶细胞中。大多数由特定基因缺陷引起的疾病都可以通过改善基因的缺陷来治疗疾病,例如编码凝血因子基因突变引起的血友病。
基因编辑技术是替换缺陷基因的有效手段,包括锌指核酸酶(zinc finger nuclease,ZFN)、转录激活因子样效应物核酸酶(TALEN)、巨型核酸酶和Cas9。近几十年来,病毒载体介导的基因治疗已被用于治疗心血管、肌肉、代谢、神经、血液和眼科疾病,以及感染性疾病和癌症的临床试验。从临床研究的反馈中,最有效的病毒载体是腺病毒载体、腺相关病毒(AAV)载体、逆转录病毒载体和慢病毒载体。其中AAV载体在体内基因治疗中最有前景,而逆转录病毒载体和慢病毒载体是临床体外基因治疗的首选载体。
腺相关病毒(AAV)载体介导的基因传递最近被批准用于治疗遗传性失明和脊髓性肌萎缩症(SMA),对其他罕见疾病也取得了长期疗效,包括血友病和杜氏肌营养不良症。然而,目前的研究表明,AAV载体的遗传修饰可能进一步促进AAV基因治疗的成功。载体工程可以提高AAV转导效率(通过优化转基因表达盒)、载体趋向性(使用衣壳工程)、衣壳和转基因避免宿主免疫反应的能力(通过遗传修饰这些成分),以及优化AAV的大规模生产。小编在这里给大家推荐Li C和Samulski RJ发表在《Nature Reviews Genetics》题为“Engineering adeno-associated virus vectors for gene therapy”综述文章,本综述重点论述AAV载体的独特特征,包括广泛的趋向性、低免疫原性、很少整合到宿主染色体中、介导基因的长期表达等。并讨论如何通过基因工程来增强AAV载体的感染,及逃逸患者的免疫反应。同时关注如何在未来的临床试验中把握AAV载体介导的基因治疗的效率。

一、AAV载体
AAV是一种单链DNA病毒,其基因组由rep基因和cap基因组成,其两侧分别有两个反向末端重复序列(ITRs)。rep基因编码单个开放阅读框(ORF),有助于AAV基因组的复制和病毒颗粒的组装。病毒衣壳蛋白由cap基因的ORF产生。此外,衣壳组装所必需的装配激活蛋白(AAP)是由cap基因内移框的ORF所编码。
AAV通过结合细胞表面的主要受体和辅助受体来感染靶细胞,从而触发细胞的内吞作用进入细胞。进入细胞后,AAV病毒颗粒释放并聚集在细胞核周区域,当病毒进入细胞核,AAV病毒颗粒会释放它们的单链基因组,该基因组被转化为双链DNA,进而介导病毒基因的转录和翻译。AAV的ITRs是重组AAV扩增所必需的,该序列可以诱导基因表达,并在载体生产和确保病毒在细胞的转导中发挥关键作用。目前在AAV基因组中有96%基因可以被删除或替换,扩大了工程化AAV用于基因治疗的灵活性。
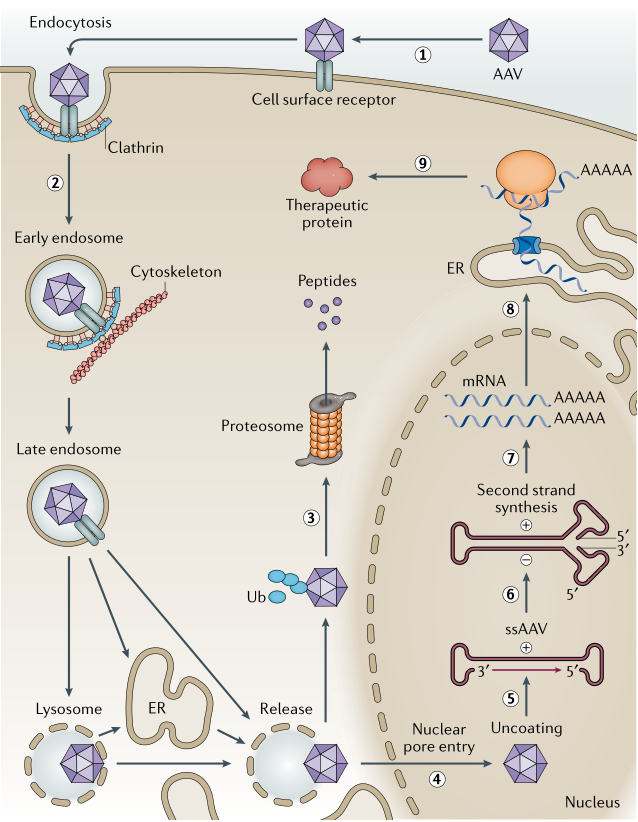
图1. AAV病毒感染的途径
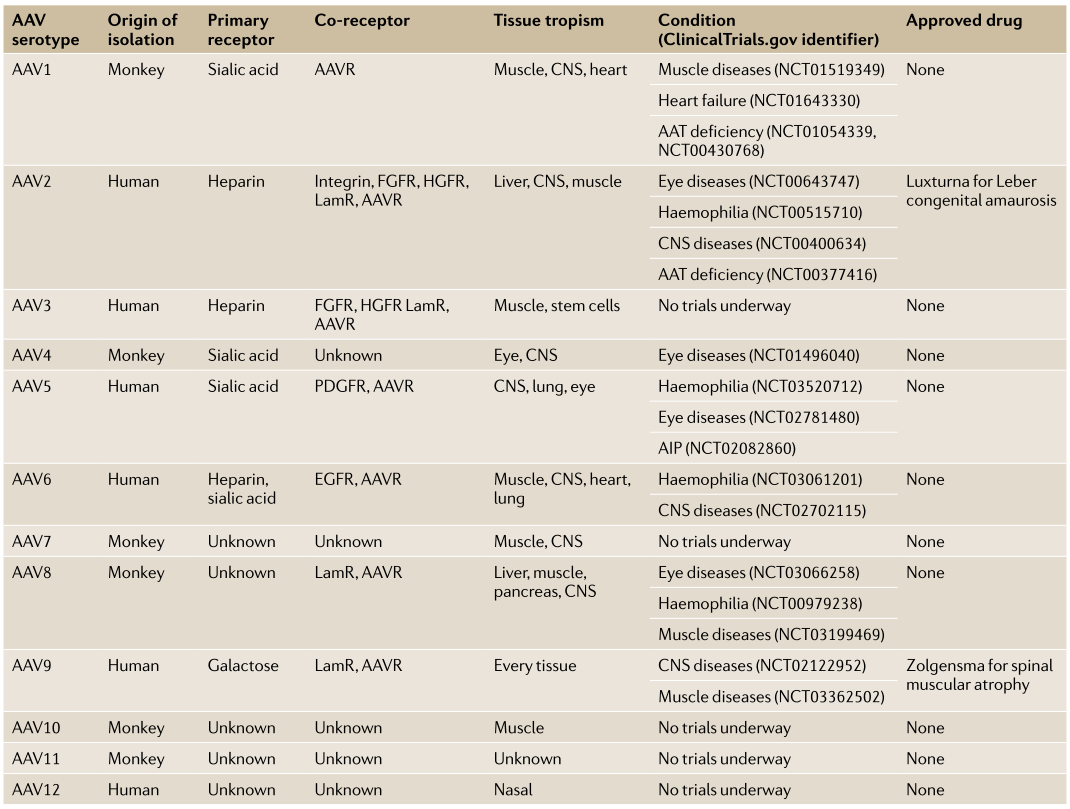
到目前为止,至少有12种天然AAV血清型和100多种工程化的AAV变异体被开发作为基因递送工具,并从这些载体中不断衍生出更多的AAV突变体,以优化AAV在基因治疗中的作用。不同的AAV血清型具有不同的结合受体和组织趋向性,已经有多种AAV血清型应用于多种疾病的临床试验,包括AAV1、AAV2、AAV5、AAV6、AAV8、AAV9和AAVrh10,以及一些AAV突变体,包括AAV2.5、AAVSpark100、AAV.7m8和AAVtYF。
表1.不同AAV血清型的特性和临床运用
二、工程化的AAV
(一)编辑AAV基因组元件
包括通过编辑AAV的ITRs,使基因表达不需要第二链DNA的合成;通过编辑启动子序列增加病毒的转录;优化病毒序列中的密码子以增加mRNA的转录和翻译;以及改进基因的表达模式,提高rAAV载体在病毒转导时的表达效率。
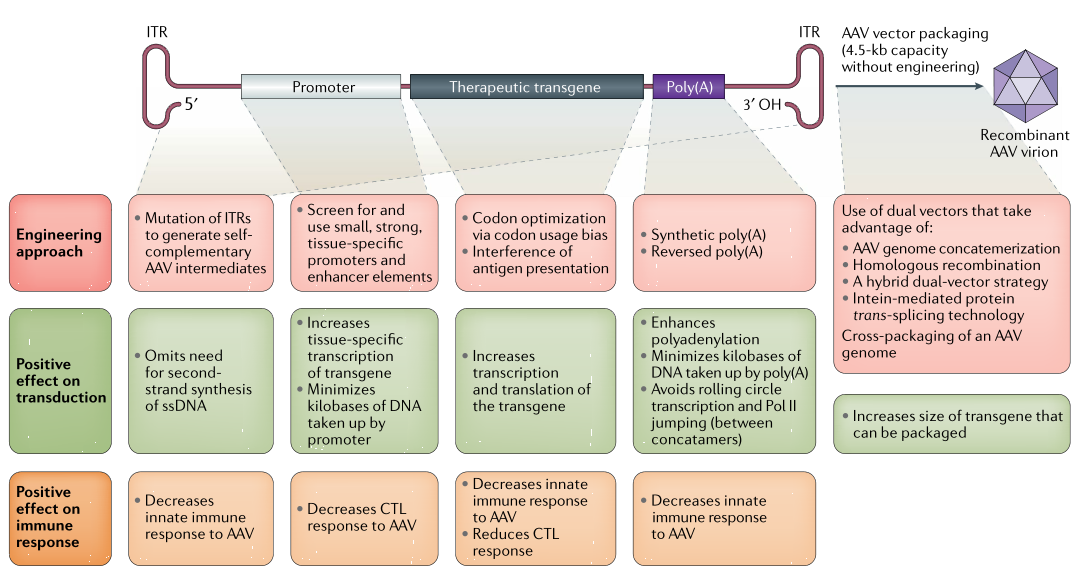
1.AAV的ITRs的优化
AAV的转导必须从单链AAV基因组合成双链DNA,才能启动mRNA转录过程。这一步骤是由ITRs所介导。突变野生型AAV的ITR可以忽略病毒扩增需要rAAV第二链合成的要求。自互补AAV(scAAV)的中间体包含正链和负链DNA,当scAAV被包裹到病毒颗粒的外壳时,会将ITR捆绑在一起,当被改变的ITR融合的scAAV的一半序列被送到细胞核时,这些一半的序列通过退火形成dsDNA,可以被实时转录。2020年,scAAV8在血友病患者的临床试验中取得成功。近期scAAV载体被FDA批准用于治疗SMA。
2.AAV启动子的优化
由于AAV的包装能力有限,因此使用的顺式元件(如启动子)必须进行优化。长启动子序列被小的顺式元件取代,从而驱动基因表达,以输送大片段治疗性转基因,可表达4.4-4.5kb的大序列基因进行治疗。近期,通过结合肝脏不同的特异性启动子和增强子元件生产出更小的启动子和增强子序列,实现rAAV的高效包装和转导。含有这些顺式调控元件和肝脏特异性启动子的rAAV在小鼠体内表达水平比单独启动子的rAAV高出约10到100倍。
3.AAV装载基因序列的优化
临床试验中使用的治疗性基因序列基本是天然的基因序列,天然基因序列的密码子可以通过优化以增强基因的表达。宿主基因组DNA被转录时对基因组的密码子有一定的偏向性,并且不同组织和不同细胞由于tRNA的差异,也存在这种密码子偏向性。因此优化用于特定组织中的基因密码子,可以提升基因的表达效率。
4.AAV载体包装的优化
许多基因序列,包括编码dystrophin(肌营养不良蛋白,用于治疗杜氏肌萎缩症)、FVIII(凝血因子八,用于治疗血友病A)和视网膜特异性磷脂转运ATPase ABCA4(用于治疗视网膜变性疾病如黄斑变性疾病)的基因,由于序列太大无法有效地包装进AAV病毒颗粒。将大片段的基因包装进入AAV,可以将AAV基因组通过ITR序列发生同源重组进而串联在一起,大的基因序列可以被分成两个或更多个载体并输送到相同的细胞,当病毒在细胞核释放后,片段之间的同源重组形成完整的基因序列。
(二)改造AAV的衣壳
目前主要有三种技术来改造AAV衣壳:合理设计、定向进化和计算设计天然衣壳。
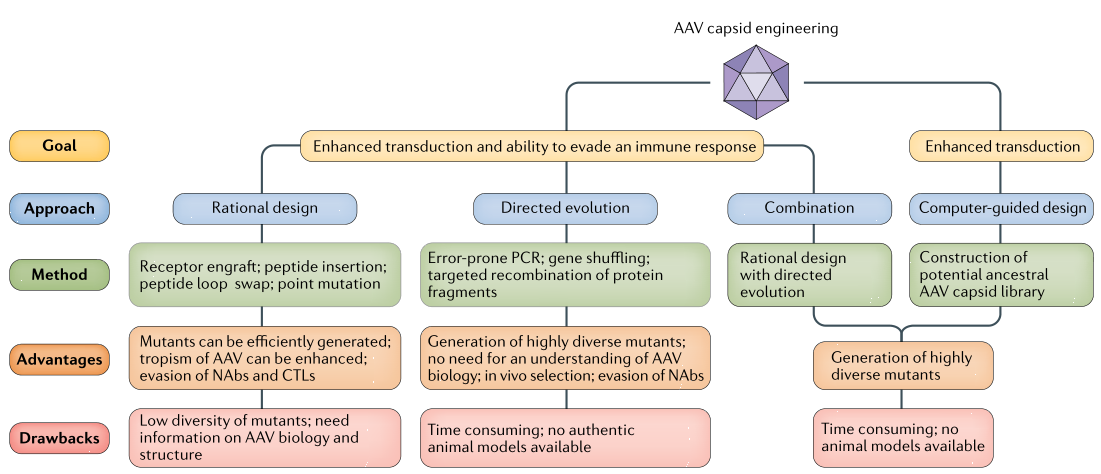
1.合理设计AAV衣壳
AAV通过与主要受体或共受体结合而附着于细胞表面,目前已经鉴定了一些AAV血清型的受体结合结构域,为AAV衣壳序列和结构的研究提供了详细的信息,这些信息使得能通过合理设计衣壳得到增强表达的AAV载体。例如,AAV1和AAV7具有高肌肉组织靶向性,通过将来自AAV1的五个保守残基移植到AAV2衣壳中,可产生具有肌肉组织靶向性的AAV2。AAV9.HR是包含突变His527Tyr和Arg533Ser的AAV9衣壳的合理设计版本,该病毒具有穿越血脑屏障和侵染神经元的能力,而在外周组织中很少表达。根据AAV衣壳结构与功能之间的联系,合理设计AAV衣壳有可能开发出靶向性的AAV衣壳,提高临床基因治疗的效率。
2.定向进化AAV衣壳
定向进化技术包括错配PCR、基因组修改、蛋白片段的定向重组、合理设计和定向进化相结合的策略、基于cre重组酶的AAV定向进化和体内定向进化,这些技术可以修改蛋白质的结构和功能,并广泛用于构建AAV衣壳。使用易错配聚合酶链式反应将不同的点突变引入AAV2的衣壳基因,在人胚肾细胞中可筛选出具有不同特性的AAV2突变体。
3.计算设计的同源AAV衣壳
使用计算设计可产生增强转导的AAV衣壳变异体。利用AAV血清型之间DNA序列和系统发育分析知识,来构建潜在的同源的AAV衣壳文库。总的来说,发现AAV血清型之间的32个可变位点适合生成AAV同源衣壳文库,这些衣壳在不同细胞系中与天然AAV血清型具有相似的感染效率,并且转导小鼠肌肉组织的效率比天然AAV1血清型更高。
三、非工程化的AAV
包括生成多倍体AAV载体、使用小分子物质增强AAV的转运,以及影响AAV结合蛋白或多肽的功能来增加AAV的转导。
1.多倍体AAV载体
一个AAV病毒颗粒由60个衣壳亚基组成,因此可以产生包含不同AAV血清型衣壳亚基的多倍体病毒颗粒,这些多倍体载体比亲本血清型具有更高的转导效率、更大的组织趋向性和更强的免疫逃逸能力。
2.小分子物质
AAV转导过程涉及病毒与受体结合,然后从内吞体释放,通过细胞内转运,在细胞核中脱壳,合成dsDNA。而小分子可以调节这些过程,尤其是细胞内的转运和第二链DNA的合成,因此可以在体外或体内增强AAV的感染。例如给予蛋白酶体抑制剂Bortezomib和carfilzomib增强了AAV在小鼠肝脏中的感染。
3.血清蛋白
当AAV载体注射进入血液中,血液中的血清蛋白可以减少或增加AAV的感染。例如当AAV8与血清白蛋白,转铁蛋白,低密度脂蛋白和非中和免疫球蛋白直接相互作用可以增强其在肝脏中的转导。
4.多肽
AAV病毒颗粒不仅能直接与血清蛋白相互作用,还可以与其他多肽相互作用以增强其转导能力。当AAV病毒与细胞渗透性多肽一起孵育时,更有利于病毒感染细胞系和小鼠肌肉。而穿梭多肽可以帮助AAV有效穿越血脑屏障。
四、工程化的AAV进行免疫逃逸
虽然AAV已经成功地应用于临床研究,但宿主的免疫反应是AAV进行有效和长期治疗性表达的主要障碍。免疫反应包括对AAV衣壳的细胞毒性T细胞反应(CTL反应),针对AAV病毒颗粒的中和抗体(NAb)反应,针对AAV感染的先天免疫反应等。AAV载体进行工程化设计以逃避免疫反应具有重要意义。
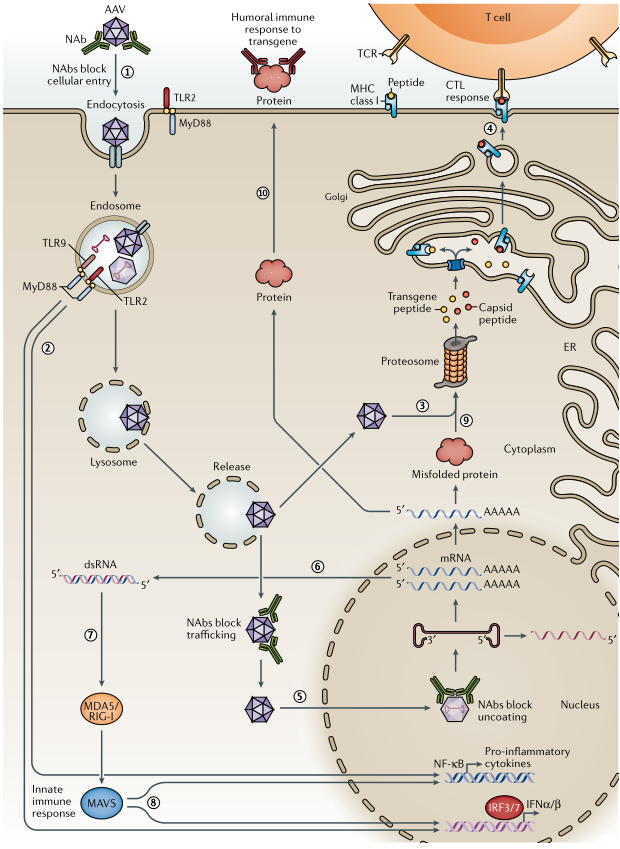
图4. AAV的免疫反应
(一)编辑AAV的基因组元件
1.改造病毒基因组逃逸适应性免疫反应
AAV递送的靶基因可以诱导适应性免疫反应,包括CTL反应和形成抗治疗性蛋白的同种抗体。使用组织特异性启动子可以限制AAV在靶细胞的转导,阻止其在抗原提呈/递呈细胞(Antigen-presenting cells,APC)中的表达,并降低靶基因诱导的CTL反应。此外,由于主要组织相容性复合体(MHC)I类途径可将靶基因产物作为抗原呈递,阻断这一途径可阻止细胞对靶基因的CTL反应。
2.改造病毒基因组干扰先天免疫反应
AAV病毒颗粒与细胞表面受体结合发生内吞作用。Toll样受体2(TLR2)和TLR9也存在于细胞表面或细胞内感知AAV。当树突状细胞被AAV侵染后,TLR9诱导先天免疫反应的发生,scAAV载体比传统的单链AAV载体诱导更强的先天免疫反应。当AAV基因组元件被设计成减少TLR9对病毒基因组CpG位点的识别时,可以避免激活TLR9介导的先天免疫反应。
(二)工程化改造AAV外壳
1.改造AAV衣壳逃避中和抗体
根据已发表的研究,目前超过90%的人类感染了AAV,其中50%的感染者可能产生了NAbs。用AAV进行全身性治疗时,NAbs成为治疗有效性的关键问题。降低NAbs水平传统方法包括使用利妥昔单抗、雷帕霉素等,阻止B细胞产生NAbs。然而传统方法要么效率低,要么改变了AAV生物学特性,或增加了AAV衣壳抗原载量,而基因改造AAV衣壳以逃避NAbs可能是有益的,目前已在尝试通过合理的设计和定向进化AAV衣壳来实现这一点。
2.改造AAV衣壳逃避CTL反应
通过合理设计,可将AAV衣壳设计成避免衣壳特异性CTL介导的清除反应。AAV感染导致衣壳抗原在靶细胞表面交叉呈递,该途径是由MHC-I类抗原呈递途径介导,泛素介导AAV衣壳的降解。衣壳中的磷酸化位点发生突变以避免泛素化和蛋白酶体介导的衣壳降解,并让AAV载体逃避衣壳特异性CTL反应。
五、AAV载体的制备及纯化
1.优化AAV载体的生产工艺
生产足够的AAV载体用于临床治疗具有一定的挑战性,对于患有神经或肌肉功能障碍的患者,通常需要每公斤体重大于1014个病毒颗粒才能有较好的治疗效果(疗效)。AAV载体通常在转染腺病毒辅助质粒(有助于产生AAV Rep和Cap蛋白)、AAV辅助质粒(编码AAV Rep和Cap蛋白)和AAV载体质粒(由AAV ITRs侧翼的转基因表达盒)的HEK293细胞中产生,悬浮培养比贴壁培养的HEK293细胞产生更多的AAV载体,是目前临床研究中最常用的AAV载体生产方式。然而,AAV载体的大规模生产也已使用稳定的HeLa细胞系-腺病毒法、疱疹病毒辅助方法和基于AAV-Bac的系统进行了测试。
2.AAV载体的纯化
目前有两种纯化AAV的技术:密度梯度离心和色谱纯化。结合这些方法能保证高纯度的AAV载体。此外AAV的几种配体已用于亲和层析,包括肝素,粘蛋白,A20单克隆抗体和树脂AVB琼脂糖。目前正在研究使用AAV衣壳表面上的位点来纯化AAV。
六、评价基因治疗方案
虽然工程化AAV,特别是在AAV衣壳的遗传修饰方面已经取得了很大的进展,但在一些动物模型中显示工程化的AAV突变体可能在其他物种中无效,因此需要开发能够评估AAV感染并预测AAV在人体试验中有效性的系统。
1.动物模型
虽然动物模型已被用于评估AAV基因治疗的疗效、毒性和免疫反应,但小鼠模型的结果并不能推广到大型动物、人类甚至其他小鼠品系。为了克服这一问题,开发了人源化小鼠模型来测试携带人体组织的小鼠中AAV血清型和突变体的感染效率,是一个较好的替代方案。
2.类器官或3D组织培养
类器官或3D组织培养系统可用于评估AAV感染的效率。类器官是体外由特定细胞分化形成的三维微型器官,已被建立用于研究疾病的发病机制和治疗效果。由于类器官是从人类细胞产生,因此可能比动物模型更能反映人类细胞真实的生理状况。
七、展望
虽然AAV基因治疗已在临床试验中显示出良好的前景,但该方案仍面临着诸多的问题,包括病毒在人类中的感染效率低于动物模型、AAV衣壳或转导靶基因的免疫反应、低效的病毒生产和纯化方案,以及缺乏可靠的系统来评估AAV转导在临床试验中的效率。
基于AAV载体的工程化修饰有可能解决上述诸多问题。目前工程化AAV衣壳可以增加AAV的侵染能力,有利于病毒逃脱中和抗体,增强转导靶基因表达,并能防止对AAV衣壳和转基因的免疫反应。因此通过工程化修饰的AAV是未来人类基因治疗的最有潜力的工具,在保持安全性和有效性的前提下,通过增加治疗效应和降低免疫反应,最终永久性改善基因缺陷患者的生活质量。

扫码下载原文

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK