2026-02-02 阅读量:21
在神经科学领域,理解记忆如何被编码、存储和提取是核心问题之一。我们的大脑能够回忆起离散经历的细节,也能将相关经历关联起来,还能从多个经历中提炼共性并应用于全新场景(记忆泛化),理解支撑这些潜在可分离过程的神经机制,是揭示大脑如何获取、组织和运用跨经历信息的核心问题。已有研究表明,单一经历的记忆会存储于该经历中活跃的神经元群体(即记忆痕迹集群)中,神经元的兴奋性竞争决定了其是否被分配到该集群。经历发生数小时后,该集群的神经元仍比邻近神经元兴奋性更高,直至12-24小时后兴奋性降低。这种兴奋性的时间起伏变化可能决定了后续经历的记忆在大脑中的组织方式,以及这些记忆是否易于泛化到全新场景。
传统的记忆研究工具,如基于即刻早期基因(IGE,如cFos)的活动依赖性标记系统(如TRAP2、RAM),通过药物诱导打开一个长达6-48小时的“标记窗口”,来捕获与训练经历相关的神经元活动。然而,这种漫长的时间进程可能导致“过度标记”——即标记到并非在相对短暂的训练经历中活跃的神经元;且缺乏足够的时间分辨率,无法探究训练经历时间邻近(如3小时)情况下,记忆关联与泛化的神经机制;另外,IGE的表达与神经元锋电位活动的关联性弱于钙信号,标记特异性有限。因此,具备短暂标记窗口并且基于钙信号的活动依赖性精准标记工具,对于深入探究介导内源性记忆关联、分离及记忆泛化的神经机制至关重要。
来自多伦多大学的Sheena A. Josselyn研究团队在Cell Reports发表了一篇题为“Examining memory linking and generalization using scFLARE2, a temporally precise neuronal activity tagging system”的研究成果,该研究采用了新型时间精准标记工具scFLARE2(单链快速光控和活动调控表达系统2),该系统基于光信号和细胞内钙信号双重调控,仅在蓝光照射与细胞活跃引发胞内钙离子浓度升高的短暂时间重叠窗内(最短可至3分钟),实现对特定细胞群体的稳定不可逆标记。借助该工具,团队研究发现:时间间隔较远(27小时)的两次威胁经历,会被分别分配至正交(相互独立)的记忆痕迹集群,进而形成离散记忆;时间间隔较近(3小时)的两次威胁经历,则通过共分配至重叠的记忆痕迹集群,建立起关联记忆。此外,研究还证实共分配机制可介导全新经历的记忆泛化。即记忆痕迹集群中神经元兴奋性的内源性时间动态演变,决定了记忆的组织与提取方式。而传统基于IEG的标记方法,因时间分辨率不足,难以开展此类高精准度的研究。
枢密科技重磅推出神经元活动标记利器——scFLARE2!该系统基于光与钙依赖的双门控原理,仅在神经元高活动(钙内流使胞内钙离子浓度升高)与特定蓝光照射同时发生的极短时间窗内(可短至3分钟)实现对活跃神经元的稳定不可逆、特异性标记,具备高时间分辨率、低背景干扰的核心优势,克服了传统基于IEG(如cFos)方法标记时间窗口宽、特异性有限的局限。选择枢密科技,解锁神经元活动精准标记新维度!相关产品见文末~
1、在单一听觉威胁记忆实验中验证scFLARE2的标记效果
scFLARE2是一个膜锚定单链融合蛋白,通过双核心组件协同实现功能:一是锚定于神经元跨膜结构域的转录因子,二是调控组件,该组件仅在高钙浓度与蓝光(BL)共同作用下可切割并释放上述转录因子;转录因子释放后转运至细胞核,可驱动四环素反应元件(TRE)调控的靶基因(如荧光报告基因、视蛋白)表达。
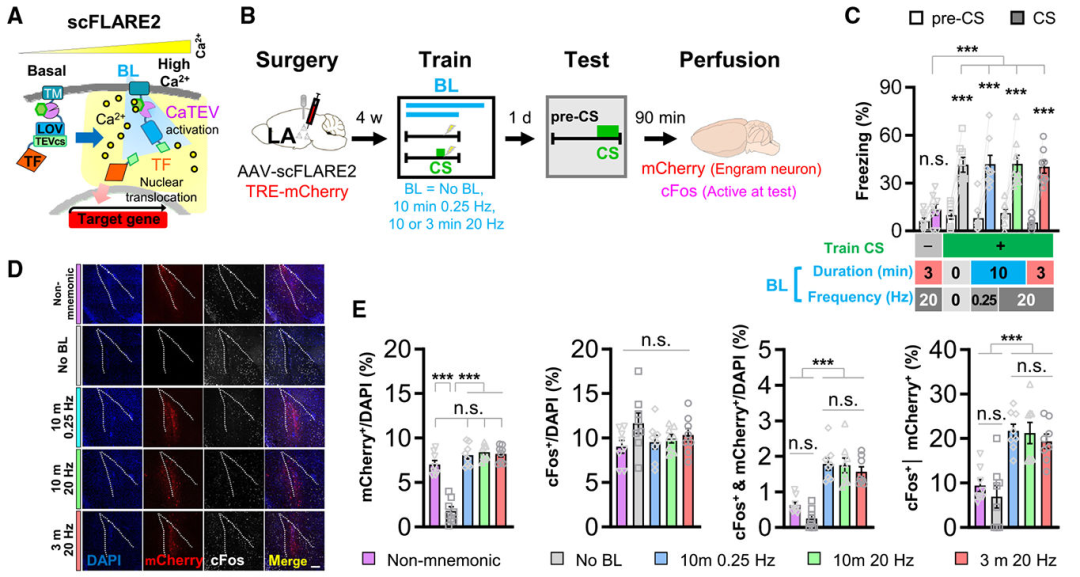
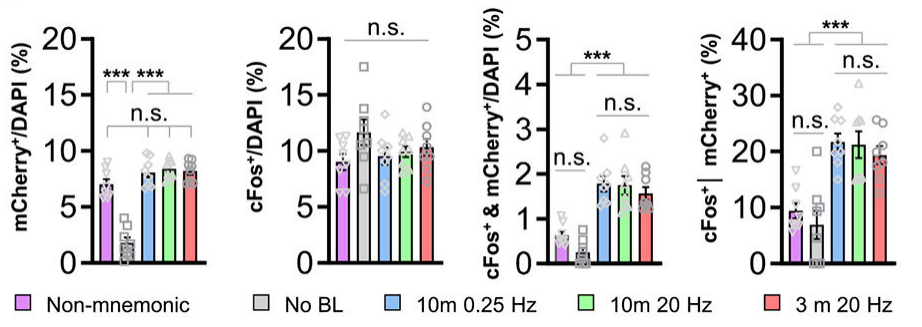
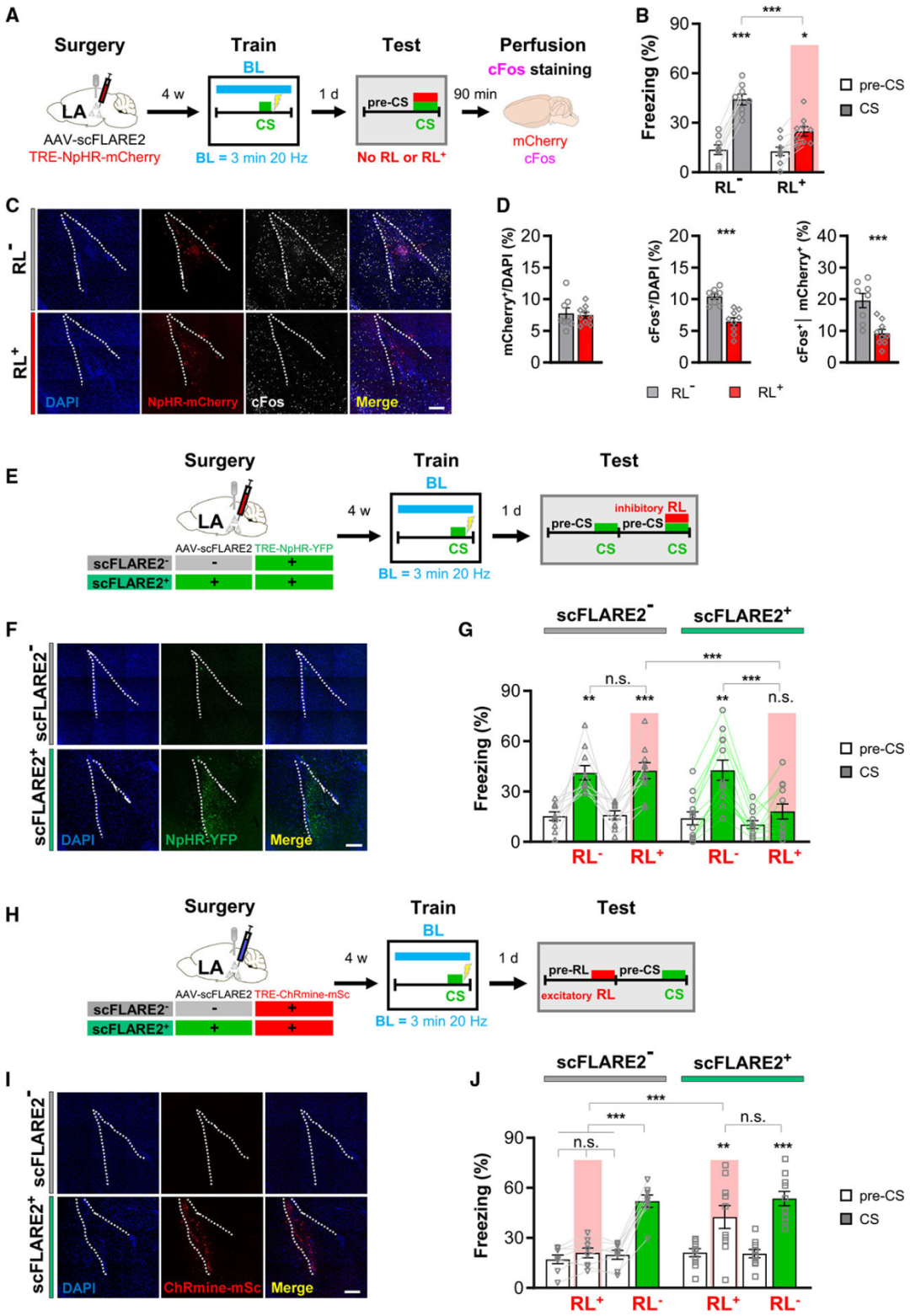
为明确scFLARE2用于记忆相关神经元标记的可行性,研究团队以小鼠听觉威胁条件反射为模型,优化并验证了蓝光照射参数。实验中,在小鼠外侧杏仁核(LA)表达scFLARE2和荧光报告基因TRE-mCherry(即蓝光照射期间钙浓度较高的神经元表达mCherry),采用“音调条件刺激(CS)+厌恶性足底电击”建立威胁记忆,训练时通过不同蓝光参数(持续时间:3分钟/10分钟;频率:0.25 Hz/20 Hz)进行照射,并设置无蓝光组(排除背景标记)和非记忆组(仅情境电击+蓝光,测试时用全新音调)作为对照。24小时后检测小鼠对音调CS的冻结行为(记忆提取指标)和cFos表达(神经元活跃指标)。
结果显示:除非记忆组(训练期间音调未与电击配对)外所有小鼠均有强烈冻结反应,无蓝光组几乎无mCherry⁺神经元,证实蓝光是标记的必需条件;3分钟蓝光照射即可有效标记训练期间活跃的LA神经元,且不同蓝光参数的标记效率无显著差异;非记忆组标记神经元(mCherry⁺)对音调CS的cFos再激活率显著低于其他训练组,凸显了scFLARE2标记的内容特异性。以上结果表明,scFLARE2的标记窗口可缩短至3分钟,这一短暂标记窗口显著优于传统基于IEG的标记系统。
图1. scFLARE2在单一听觉威胁记忆实验中的标记效果验证
2、在区别性音调威胁范式中检测scFLARE2标记的特异性
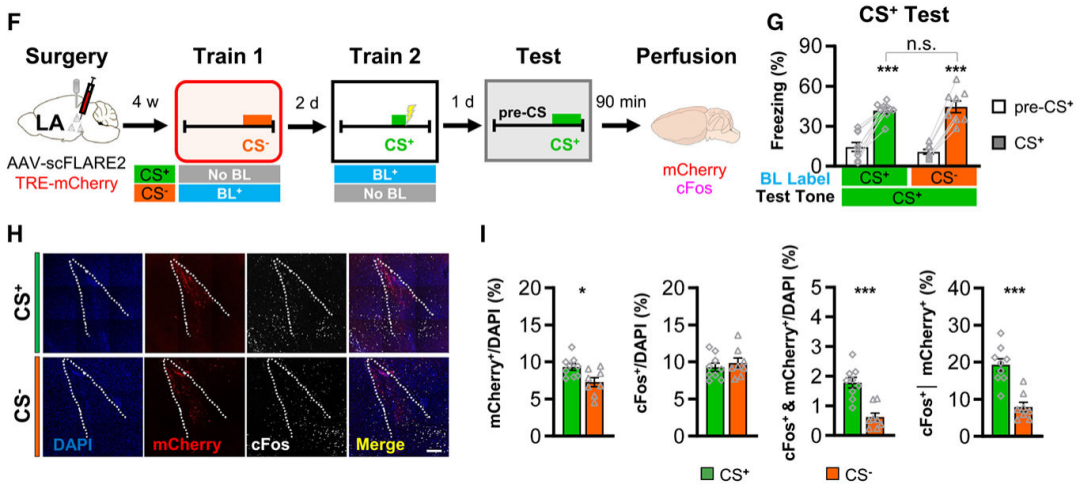
为进一步验证scFLARE2标记的时间特异性和内容特异性,团队采用区别性威胁范式,设置两组流程一致、仅蓝光照射时间段不同的小鼠:在LA神经元表达scFLARE2和TRE-mCherry的小鼠,先经历训练1——暴露于不和足底电击配对的音调(CS⁻,7.5 kHz短脉冲音),2天后经历训练2——暴露于和足底电击配对的音调(CS⁺,2.8 kHz纯音),第一组(记为CS⁻标记组)在训练1期间照射蓝光(3分钟,20 Hz),第二组(记为CS⁺标记组)在训练2期间照射相同参数蓝光,分别标记对应阶段活跃的LA神经元。24小时后,两组共同接受CS⁺威胁记忆测试:在全新环境中测试小鼠对CS⁺的冻结行为,并通过cFos免疫染色量化标记神经元的再激活比例。结果显示,两组的CS⁺冻结水平和cFos⁺神经元总数无差异(记忆形成与整体激活状态一致),但CS⁺标记组标记的神经元再激活比例显著高于CS⁻标记组。这一结果证实,scFLARE2可精准锁定“蓝光照射的特定时间段”及“与目标记忆相关的神经元”,兼具时间与内容特异性,排除非特异性标记干扰。
图2. 区别性音调威胁范式下scFLARE2标记的时间与内容特异性验证
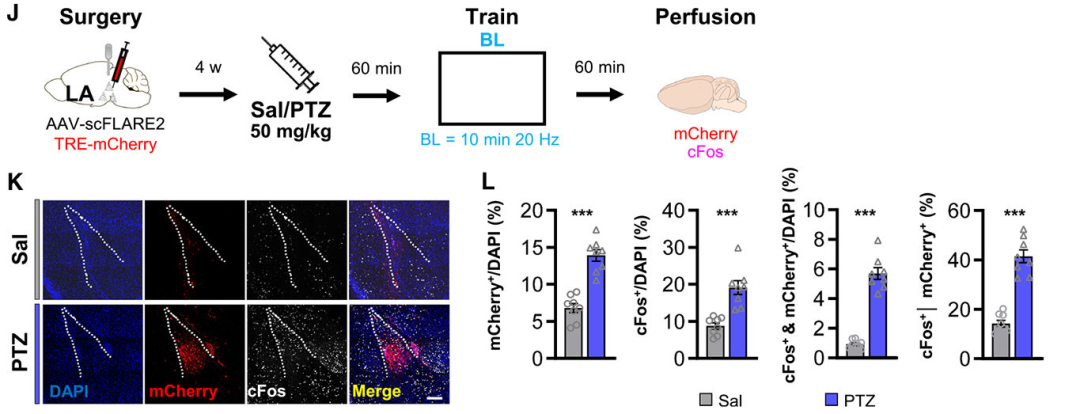
3、利用PTZ验证LA中scFLARE2标记策略的效率
为排除“标记上限”对实验结果的限制(即担心病毒载体效率导致无法标记更多活跃神经元),研究团队采用GABAA受体拮抗剂戊四氮(PTZ,可广泛激活神经元)替代听觉威胁训练,评估了scFLARE2的最大标记潜能。实验中,小鼠注射PTZ(50 mg/kg,皮下注射)或生理盐水,1小时后(PTZ诱导cFos表达高峰)照射蓝光(10分钟,20 Hz)标记激活的LA神经元(mCherry⁺),随后通过cFos免疫染色可视化活跃神经元。结果显示,与生理盐水组或听觉威胁条件反射组相比,PTZ组诱导了更多的mCherry⁺ LA神经元。此外,PTZ还诱导了mCherry⁺神经元群体中更高水平的cFos激活。这些发现证实,当前的scFLARE2病毒标记策略能够标记比听觉威胁条件反射期间(约8%)更多的神经元,排除了本研究结果受标记上限限制的可能性。
图3. 利用PTZ激活神经元以验证scFLARE2在LA中的标记效率
4、通过光遗传学操控对scFLARE2标记进行功能验证
为明确scFLARE2标记的神经元是否为特定记忆提取所必需且充分,研究团队进行了光遗传学操控实验。沉默实验中,在小鼠LA表达scFLARE2和TRE-eNpHR3.0-mCherry,使听觉威胁训练期间被scFLARE2标记的神经元能够表达红光(RL)敏感的抑制性视蛋白eNpHR3.0。听觉威胁训练期间蓝光标记活跃神经元,测试时红光照射沉默标记的神经元。结果显示,红光沉默后,小鼠对音调刺激的冻结水平显著下降,且标记神经元的cFos再激活率同步降低。此外,在另一组小鼠中,红光照射仅在表达scFLARE2的小鼠(scFLARE2⁺ vs scFLARE2⁻)中损害记忆的提取,证实训练期间被scFLARE2标记的神经元对后续的记忆提取是必要的。
在激活实验中,实验组(scFLARE2⁺)小鼠表达scFLARE2和TRE-ChRmine-mScarlet,使听觉威胁训练期间被scFLARE2标记的神经元能够表达红光敏感的兴奋性视蛋白ChRmine;对照组(scFLARE2⁻)小鼠则不表达scFLARE2。训练期间进行蓝光标记,但测试时在无音调刺激的全新环境中进行红光照射。结果显示,仅scFLARE2⁺小鼠在红光照射期间出现显著冻结行为,且冻结水平与音调刺激诱导的相当,证实激活标记神经元足以模拟记忆提取。两项实验共同验证了scFLARE2标记的神经元与特定记忆的功能关联性。
图4. 在听觉威胁条件反射期间光遗传学操控LA中scFLARE2标记的神经元以验证其对记忆的重要性
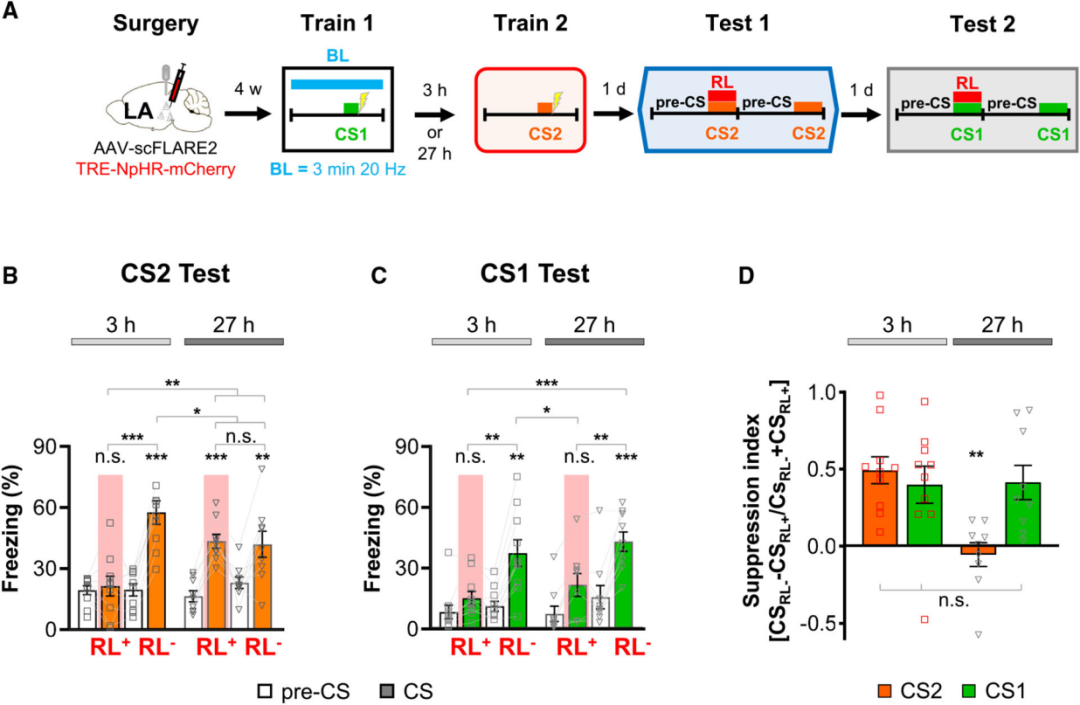
5、利用scFLARE2探究内源性神经元兴奋性小鼠的记忆关联与分离
接下来,团队使用该技术在不经人工操控的、具有内源性神经元兴奋性的小鼠(即正常小鼠)中,探究记忆关联与分离的内源性神经机制。在表达scFLARE2和TRE-eNpHR3.0-mCherry的小鼠中,进行两次听觉威胁条件反射训练:训练1为CS1(2.8 kHz纯音)+电击,训练2为CS2(7.5 kHz短脉冲音)+电击,两次训练间隔为3小时(时间邻近)或27小时(时间间隔较远)。训练1期间进行蓝光照射,标记活跃神经元的同时使其表达eNpHR3.0,后续在红光关闭(RL⁻)和红光开启(RL⁺)条件下,分别检测小鼠对CS2和CS1的记忆。
结果显示,无论间隔时间长短,沉默训练1标记的神经元均会显著破坏小鼠对CS1的记忆提取(冻结水平下降);但对于CS2的记忆,仅3小时间隔组的冻结水平被显著抑制,27小时间隔组无明显变化。各组小鼠中,红光诱导的CS1冻结抑制程度相近,但仅3小时组的小鼠表现出显著的红光诱导CS2冻结抑制。这一结果证实,时间邻近的两次经历会通过“共分配”共享重叠的记忆痕迹集群,实现记忆关联;而时间间隔较远的经历则通过“分离分配”占用正交的记忆痕迹集群,实现记忆离散。这一机制源于记忆痕迹神经元兴奋性的内源性时间动力学。重要的是,正是scFLARE2仅3分钟的精准时间标记窗口,才能捕捉内源性兴奋性调控的神经元分配差异;而传统标记工具窗口过长,无法区分短时间窗的神经元激活特异性,也就无法揭示这一记忆编码机制。
图5. 利用scFLARE2探究内源性神经元兴奋性小鼠的记忆关联与分离
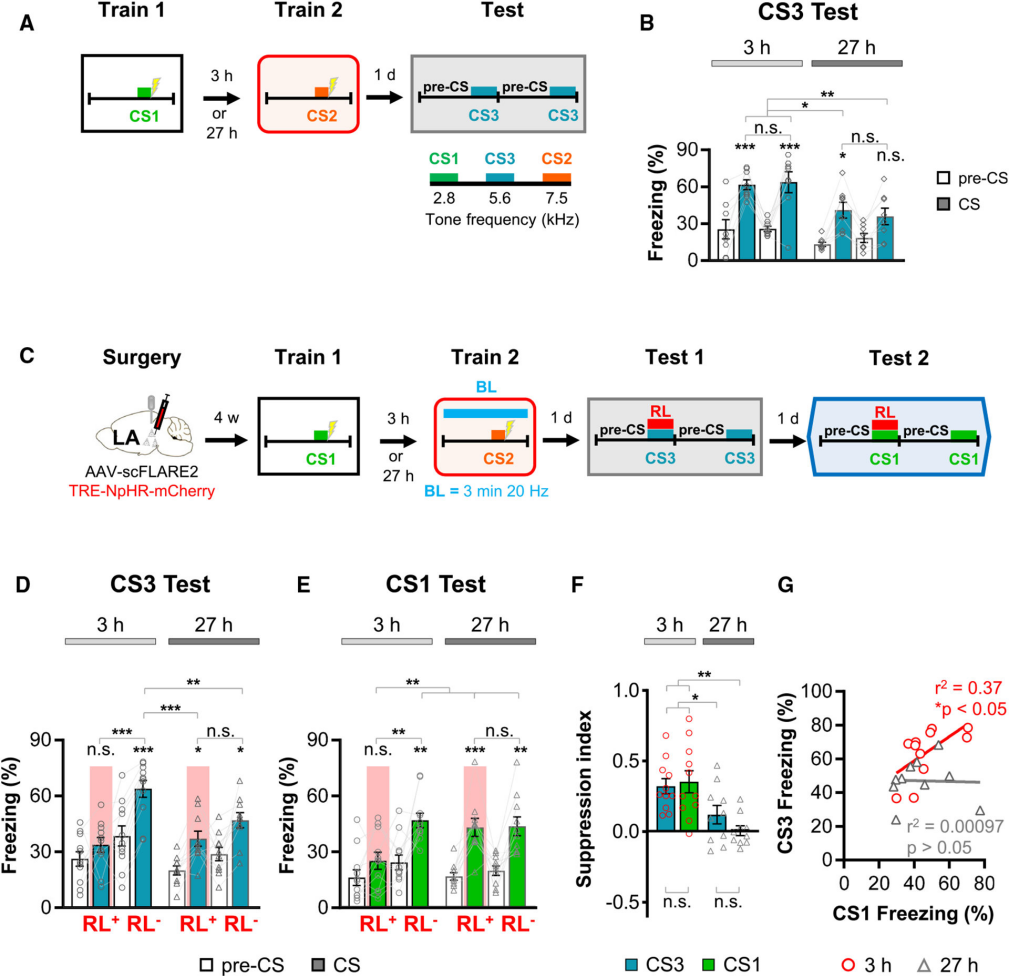
6、利用scFLARE2探究重叠记忆痕迹集群的共分配作为记忆泛化的基础
为探究记忆泛化的神经基础,研究团队在上述两次训练范式基础上,引入全新音调刺激CS3(5.6 kHz,频率介于CS1和CS2之间),评估小鼠对CS3的冻结行为(记忆泛化指标),并通过光遗传学沉默训练2期间标记的神经元,探究共分配与泛化的关联。结果显示,3小时间隔组对CS3的冻结水平显著高于27小时间隔组,表明时间邻近诱导的共分配能够促进记忆泛化。进一步的沉默实验显示,仅3小时间隔组中,抑制训练2标记的神经元会同时显著降低CS3和CS1的冻结水平,且无红光照射时CS1与CS3的冻结水平呈正相关;27小时间隔组无上述效应。这表明,共分配形成的重叠记忆痕迹集群不仅关联了CS1和CS2的记忆,还构建了泛化记忆表征,使得小鼠能将威胁记忆延伸至具有共性的全新刺激,证实共分配是记忆泛化的重要神经基础。
图6. 探究介导记忆泛化的神经编码策略
总结
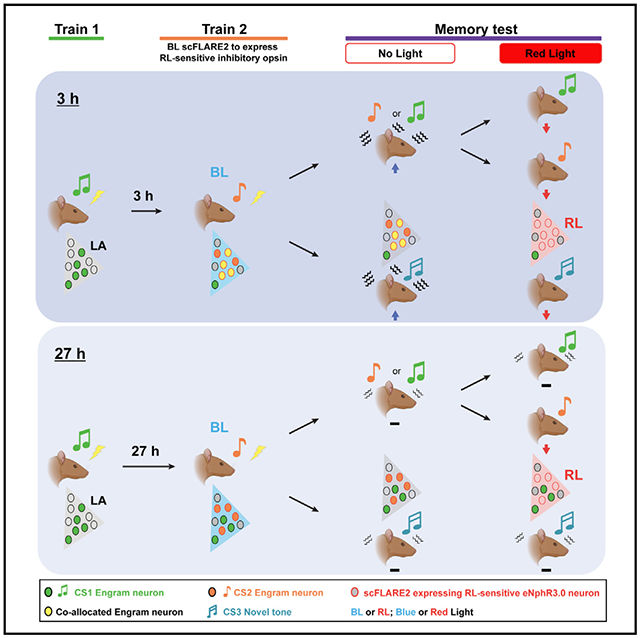
本研究利用高时间分辨率的scFLARE2标记系统,揭示了大脑组织多重记忆的核心原理:时间间隔通过调控记忆痕迹集群的神经元分配模式(共分配/分离分配),决定记忆的关联或离散,且共分配机制介导了对全新刺激的记忆泛化。scFLARE2克服了传统IGE标记系统的时间分辨率缺陷,使得在无人工操控的内源性条件下,验证了神经元兴奋性时间动态对记忆组织的调控作用,为记忆相关研究提供了强大工具。
研究结果支持“时间背景模型”,与人类记忆关联/分离的时间规律一致,且为理解泛化的神经机制提供了新视角——训练时形成的共分配记忆痕迹集群可直接介导泛化。该发现不仅深化了对大脑记忆处理规律的认知,还为机器学习领域的泛化算法研发提供了生物学启发。局限性在于未直接监测神经元兴奋性的实时动态,且仅探究了听觉刺激的泛化,未来需结合在体钙成像等技术,进一步拓展至多模态刺激场景。
总结图
我司可提供scFLARE2病毒产品,部分列表如下:


详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK