2025-12-15 阅读量:336
简介
WGA是从小麦胚芽提取的凝集素蛋白,既能顺行追踪(从神经元胞体到轴突末梢),也能逆行追踪(从轴突末梢到胞体),适用场景广泛。WGA通过网格蛋白介导的内吞作用进入细胞,此过程依赖于其与细胞膜表面糖缀合物中N-乙酰葡糖胺(GlcNAc)和唾液酸残基的特异性结合。
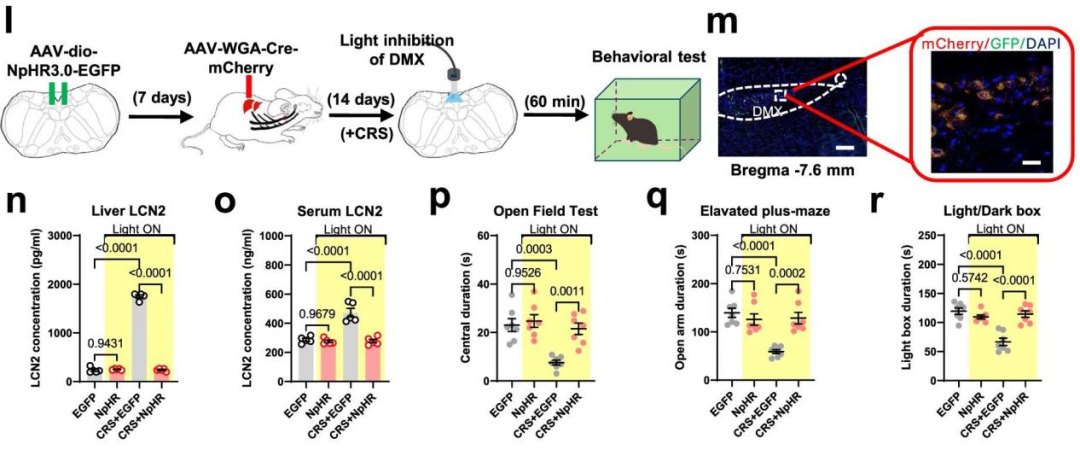
图1.慢性束缚应激(CRS)期间,光遗传学抑制迷走神经背侧运动核(DMX)中支配肝脏的神经元活性,可有效抑制肝脏脂质运载蛋白2(LCN2)的激增,并逆转CRS诱导的焦虑样行为。(WGA逆行跨突触。IF=16.6,客户文章,Yan L, Yang F, Wang Y, et al. Nat Commun. 2024;15(1):3034. Published 2024 Apr 8. doi:10.1038/s41467-024-47266-9)
应用场景
1.顺行示踪
文献1
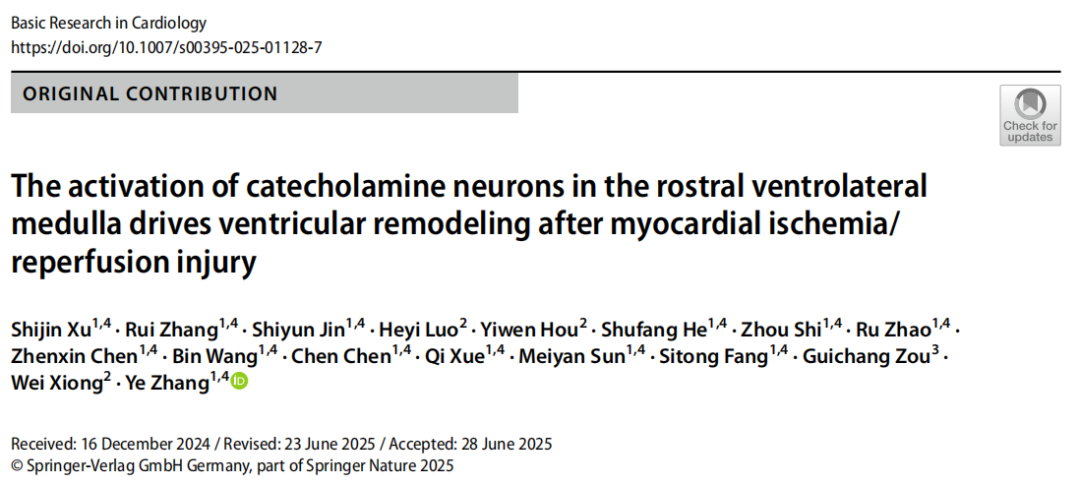
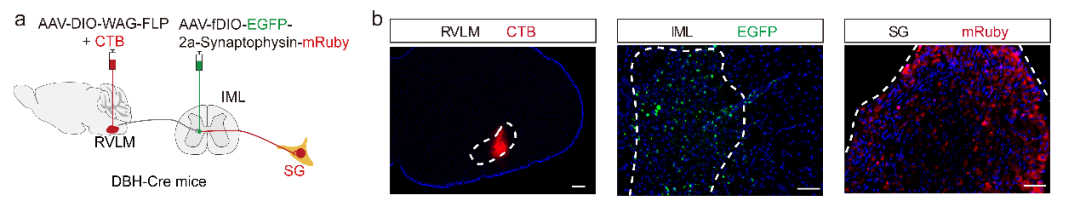
为进一步验证酪氨酸羟化酶(TH)阳性延髓头端腹外侧区(THRVLM)与星状神经节(SG)之间的解剖学连接,研究者向多巴胺β羟化酶(DBH)-Cre转基因小鼠的单侧RVLM注射顺行单突触示踪病毒AAV-DIO-WGA-FLP,并混合霍乱毒素B亚基(CTB)以标记注射位点,随后向脊髓中间外侧柱(IML)注射AAV-fDIO-EGFP-2a-Synaptophysin-mRuby病毒(突触前定位标记)。通过CTB事后验证RVLM内病毒注射的靶向准确性,且EGFP信号局限于IML区域。值得注意的是,在SG中观察到了来自IML区脊髓节前神经元(SPNs)的mRuby信号。
图2.从RVLM到SG的多级顺行示踪。(IF=8,客户文章,Xu S, Zhang R, Jin S, et al. Basic Res Cardiol. 2025;120(5):835-854. doi:10.1007/s00395-025-01128-7)
文献2
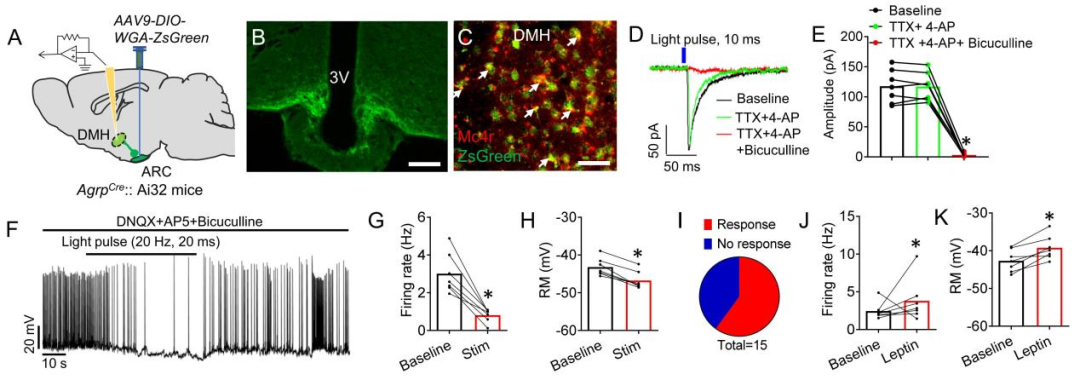
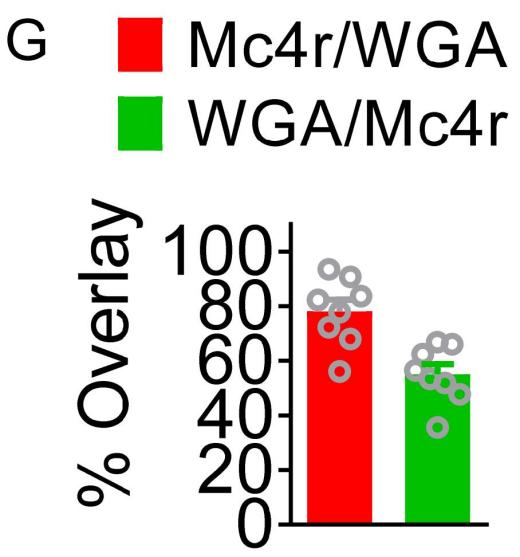
为明确下丘脑背内侧核(DMH)在瘦素响应性AgRP(刺鼠相关蛋白)神经环路中的作用,作者结合跨突触示踪蛋白(WGA-ZsGreen)与全细胞膜片钳记录技术,对AgRP神经元支配的DMH神经元进行电生理分析。研究人员向AgrpCre::Ai32小鼠的弓状核(ARC)注射Cre依赖的示踪病毒AAV9-DIO-WGA-ZsGreen(可标记存在突触连接的神经元)。Ai32小鼠会在Cre介导的重组作用下表达ChR2/EYFP融合蛋白。RNA原位杂交结果证实,DMH中约78%被AgRP神经元支配的神经元表达黑皮质素4受体(MC4R,内源性特异性拮抗剂为AgRP)。
为验证该连接是否为单突触连接,向灌流液中加入河豚.毒素(TTX,阻断钠通道,抑制动作电位产生)与4-氨基.吡啶(4-AP,钾通道阻滞剂)以消除任何网络活动。结果显示,光刺激表达ChR2的AgRP神经元轴突末梢所诱发的DMH神经元抑制性突触后电流(IPSCs)可被荷包牡丹碱(Bic,GABAA受体拮抗剂)完全阻断,证实这些末梢释放γ-氨基丁.酸(GABA)。在DNQX(竞争性AMPA/红藻氨酸受体拮抗剂)、AP5(选择性NMDA受体拮抗剂)与Bic共同存在的条件下,光刺激表达ChR2的AgRP神经末梢,以可逆方式抑制了DMH中ZsGreen阳性突触后神经元的动作电位,且这些神经元的放电频率与静息膜电位均显著降低。进一步探究了瘦素对DMH中ZsGreen阳性突触后神经元放电活动的影响,发现瘦素全身处理显著增强了DMH神经元的神经活动。
图3.瘦素响应性AgRP神经元直接支配DMH神经元。(IF=8.713,Han Y, He Y, Harris L, Xu Y, Wu Q. Elife. 2023;12:e82649. Published 2023 Apr 12. doi:10.7554/eLife.82649)
2.逆行示踪
文献1
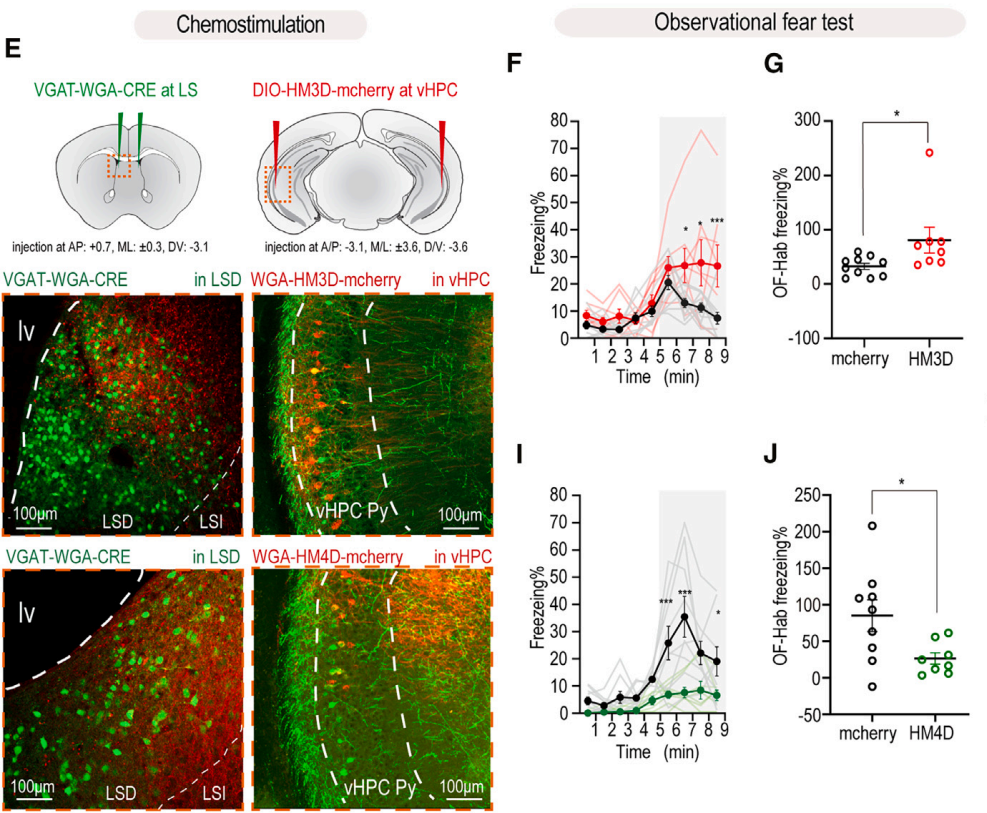
为验证腹侧海马(vHPC)与外侧隔核(LS)之间参与观察性恐惧(OF)形成的直接连接。由于大多数LS神经元为GABA能神经元,且海马向LS投射并调控本能行为的通路中,绝大多数是海马谷氨酸能锥体神经元与LS GABA能神经元之间的连接,于是,研究人员在背外侧隔核(dLS)GABA能神经元中特异性表达WGA,以检测vHPC→dLS的激活/抑制对OF能力的影响。实验设计为:向双侧dLS注射腺相关病毒血清型9(AAV9)介导的VGAT-WGA-CRE-EGFP病毒(即跨单突触工具),同时向双侧vHPC注射AAV9-DIO-hM3D(Gq)(或hM4D(Gi))-mCherry病毒。结果显示,化学遗传学激活投射至dLS的vHPC神经元,提高了实验小鼠的OF能力。相反,化学遗传学抑制投射至dLS的vHPC神经元,降低了实验小鼠的OF能力。这表明,双侧vHPC→LS环路负责双向介导OF。
图4.vHPC→dLS环路参与OF形成。(IF=8.8,客户文章,Peng S, Yang X, Meng S, et al. Cell Rep. 2024;43(6):114277. doi:10.1016/j.celrep.2024.114277)
文献2
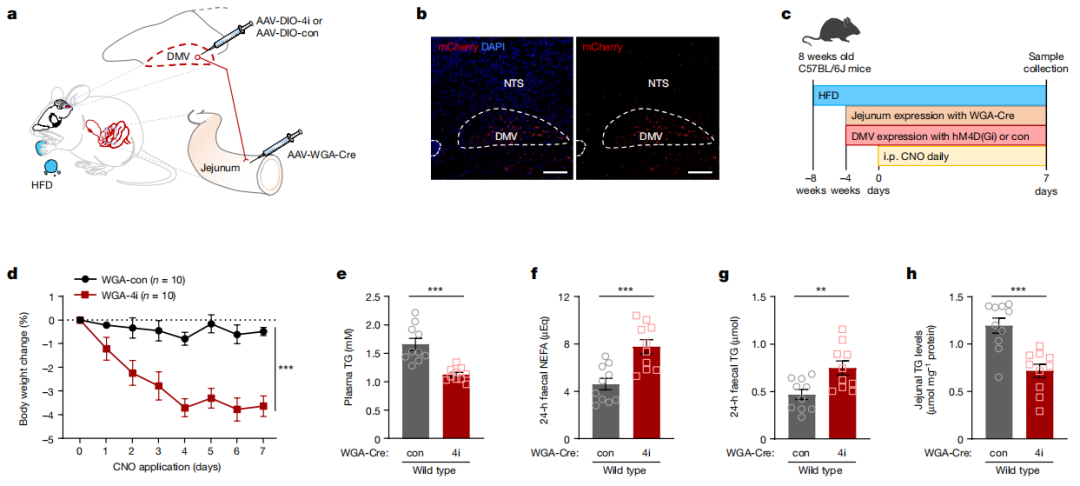
来自DMV的迷走神经纤维投射至胃肠道的不同节段。为靶向投射至空肠的DMV神经元,科研人员向野生型小鼠的空肠内注射了一种逆行AAV,该病毒编码WGA与Cre重组酶的融合蛋白(AAV-hSyn-WGA-Cre-P2A-mCherry,简称AAV-WGA-Cre)。同时,向DMV区域注射Cre依赖且编码hM4D(Gi)的AAV或Cre依赖的对照AAV,从而能够对投射至空肠的DMV神经元进行化学遗传学操控。结果显示,化学遗传学抑制(4i)组小鼠的体重增长减少、血浆甘油三酯(TG)水平降低、粪便脂肪排泄增加且空肠脂肪吸收减少。这些结果表明,投射至空肠的DMV神经元可直接调控脂肪吸收与体重增长。
图5.投射空肠的DMV神经元调控脂肪吸收与体重增加。(IF= 50.5,客户文章,Lyu Q, Xue W, Liu R, et al. Nature. 2024;634(8035):936-943. doi:10.1038/s41586-024-07929-5)
我司可提供AAV-WGA-CRE、AAV-DIO-WGA等病毒产品,更多产品及详情欢迎咨询!

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK