2025-10-13 阅读量:840
简介
在神经科学研究中,我们常常需要观察肉眼不可见的细胞与环路动态。无论是解析神经元的精细结构,还是追踪不同脑区之间的复杂连接,都需要一种能够精准“标记”目标的方法,荧光蛋白(Fluorescent Protein,FP)正是这样的关键工具。当通过病毒载体将FP递送至细胞后,它不仅能清晰显示神经元形态、评估病毒感染效率与范围,还可用于活体动态观测,长期追踪细胞或环路变化;此外,在与光遗传、化学遗传等技术联用时,FP也能为功能实验提供可靠的定位参照。了解FP的基本原理、常用类型与选用策略,对实验设计至关重要。本文将从基础出发,梳理这些关键知识点,帮助您更好地理解病毒载体中的荧光“工具”。
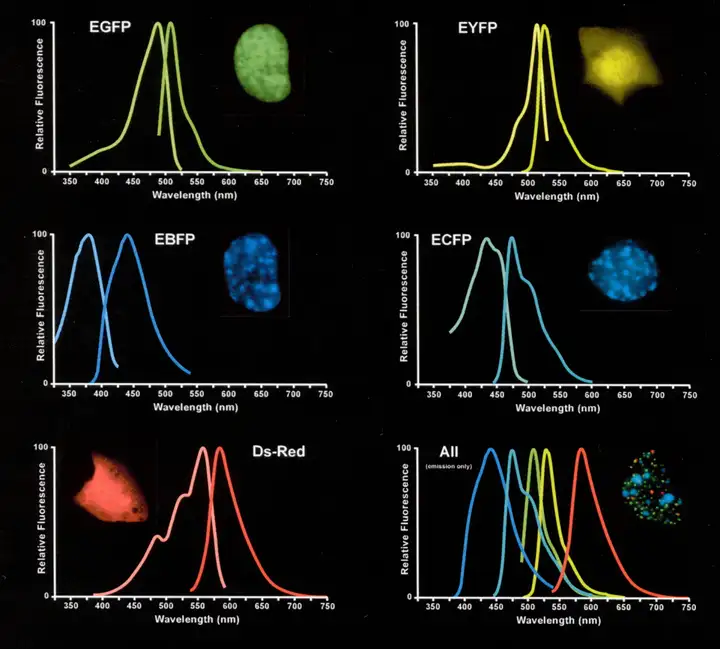
图1. 不同FP的荧光光谱(Su WW., Microb Cell Fact, 2005.)
基本原理
FP通常由约220至240个氨基酸组成(多聚体、融合改造FP除外),其特殊之处在于:不需要额外添加底物或辅酶,仅依赖自身特定氨基酸残基在三维结构中经环化、氧化形成发色团(chromophore),在特定波长激发光照射下,即可发射出相对于激发光波长更长、能量更低的可见荧光。自20世纪60年代从水母中首次发现绿色FP(GFP)以来,科学家们通过基因工程和蛋白质工程技术,已经开发出了一系列颜色、性能各异的变体,形成了一个覆盖红色、橙色、黄色、青色、蓝色的“FP调色盘”。
将编码FP的基因通过病毒载体(如腺相关病毒(AAV)、慢病毒(LV)、腺病毒(AdV)等)导入目标细胞后,细胞会利用自身合成系统表达该蛋白,使细胞在荧光显微镜下发出明亮荧光。作为基因编码标记,其优势在于能够通过整合型病毒载体(如LV),实现荧光标记随细胞分裂而稳定遗传;更重要的是,借助病毒载体的特异性(如特定启动子、血清型等),实现对标记细胞类型与时间的精准控制,极大推动了细胞生物学、神经科学、遗传学等领域的发展。
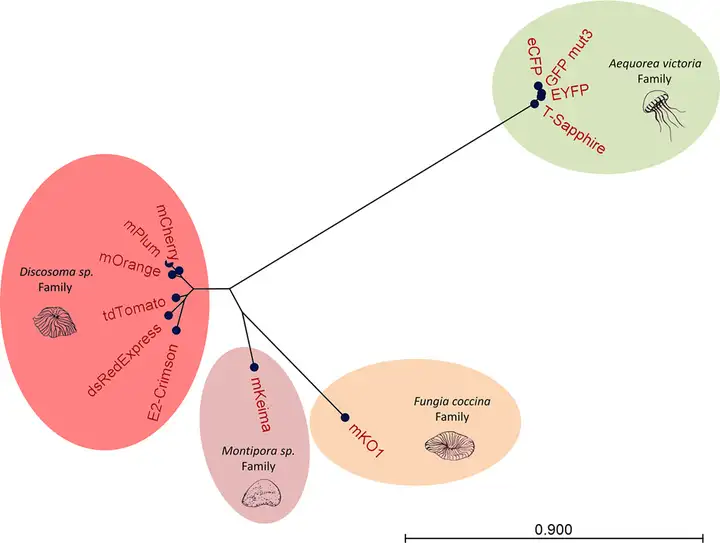
图2. 不同FP序列的径向邻接树(Barbier M, Damron FH., PLoS One, 2016.)
常用FP及其特性
1.绿色与黄色FP
GFP是这一家族的奠基者。随后开发的EGFP(增强型GFP)具有更高的亮度、表达效率以及稳定性,其激发波长约488 nm,发射波长约507 nm,这一光谱特性使其能直接使用实验室最常用的绿色荧光检测滤镜观察,无需额外配备专用设备,是目前应用最广泛的绿色FP之一。但需要注意的是,EGFP对酸性环境敏感,当pH<6时荧光会明显衰减,在溶酶体等酸性亚细胞结构中可能因荧光淬灭导致信号丢失,实验中需根据标记区域的pH环境评估适用性。
黄色FP(YFP)是GFP经氨基酸突变衍生的FP,核心代表为EYFP(增强型)。其激发波长约513 nm,发射波长约527 nm,荧光呈明亮黄色。EYFP优化了折叠效率与亮度,成熟速度快(约40分钟),同样对酸性环境敏感(pH<6.5时荧光衰减)。适用于多色标记中与红/蓝色FP组合,在神经科研中广泛用于标记神经元亚结构(如突触前膜)或追踪蛋白动态。
2.红色与橙色FP
dsRed是继GFP之后,从珊瑚虫(类珊瑚目 Discosoma sp.)中分离出的首个红色FP,它的激发、发射波长分别约为558 nm和583 nm,发射出明亮的橙红色荧光。dsRed的核心优势在于其红色光谱带来的高组织穿透力和低背景自发荧光,使其非常适用于厚样本成像及活体动物实验。然而,作为早期蛋白,其存在明显局限性:成熟缓慢,且易形成四聚体。这种寡聚化特性会干扰与其融合的目标蛋白的正常定位与功能,限制了其在精细亚细胞标记中的应用。
mCherry是目前应用最广泛的单体红色FP之一,核心优势有两个:一是光稳定性强——相比绿色FP,mCherry在长时间激发光照射下荧光衰减率更低,不会因为“褪色”而丢失神经细胞的追踪信号,这使其成为需要进行长时间(数小时甚至数天)动态观察或三维重构实验的理想选择;二是组织穿透性更好——其波长(mCherry的激发波长约587 nm,发射波长约610 nm)比绿色更长,有更深的组织穿透力,因此非常适用于厚组织样本或活体动物成像。
mRuby是另一种高亮度的单体红色FP,其亮度甚至超过了mCherry,其激发波长约558 nm,发射波长约605 nm,在某些应用中可以作为mCherry的替代。然而,mRuby的光稳定性相对mCherry稍逊一筹,因此在需要长时间成像的实验中可能不是最佳选择。
橙色FP mOrange,其激发波长约548 nm,发射波长约562 nm,亮度显著高于早期黄色FP(如YFP),且成熟速度快(约40分钟即可成熟),适合需要快速观察荧光信号的实验——比如神经细胞的瞬时转染实验,或短时间内追踪神经元突起的动态变化。不过需注意,mOrange系列的发射光谱与红色FP(如mCherry)存在少量重叠,若同时使用两种蛋白进行双标,需选择光谱分离度更高的滤镜组,避免荧光串扰。
tdTomato虽常被归为红色FP,但光谱更偏橙红,也可纳入橙色FP范畴。它是由两个改造后的dTomato单体串联形成的二聚体FP,激发波长约554 nm、发射波长约581 nm,亮度高于mCherry,是目前已知最亮的FP之一,这种高亮度使其在检测低表达蛋白或深层组织成像中优势显著。但需注意,其多聚体(二聚体)特性可能干扰融合蛋白的功能或亚细胞定位,设计融合实验时需谨慎;若目标蛋白分子量较大或定位对空间结构不敏感,tdTomato仍是优质选择。此外,它与mCherry同为光稳定性优异的FP,但约54 kDa的较大分子量,是其作为融合标签时需权衡的点。
3.蓝色与青色FP
如EBFP(蓝色,激发波长约380-400 nm,发射波长约440-450 nm)、ECFP(青色,激发波长约430-440 nm,发射波长约470-480 nm)等。由于蓝光对细胞的光毒性相对较大,且肉眼和多数探测器对蓝、青光区域敏感度较低,它们的应用不如绿色和红色FP广泛,但在多色标记体系中作为第三个或第四个颜色时非常有用——其光谱与绿、红色FP重叠率极低,能有效避免荧光串扰,适合同时追踪多种细胞或分子目标。
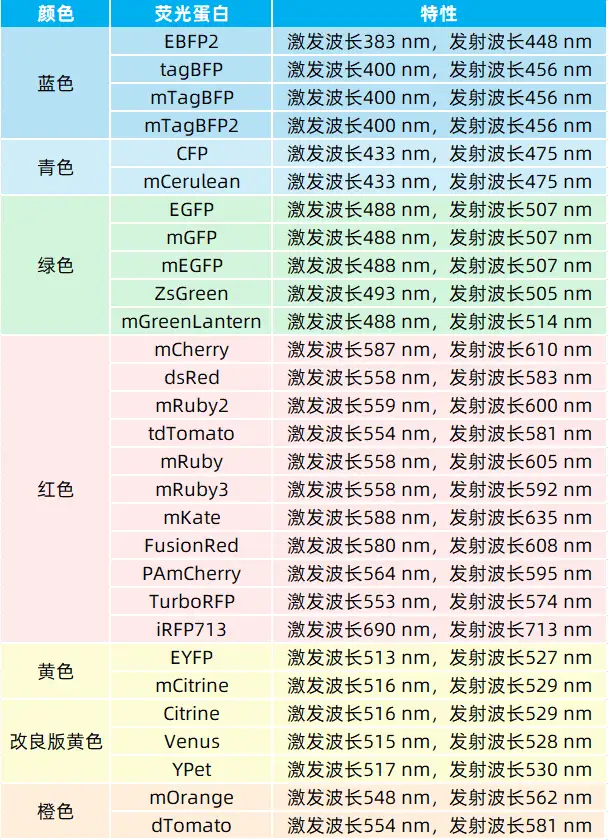
表1. 我司部分FP
FP在神经科学研究中的典型应用
在神经科学领域,FP的应用极为广泛,以下列举几个核心场景:
1.细胞标记与形态重建
这是最基本也是最重要的应用,通过病毒载体特异性感染某一类神经元并表达明亮的FP,我们可以在显微镜下清晰看到神经元的完整形态,包括它的胞体、树突、轴突乃至精细的树突棘,从而进行三维形态重建。
2.评估病毒载体感染效率与范围
在进行基因操作(如基因敲降、过表达)等实验时,病毒载体中携带的FP报告基因是判断感染是否成功的直接证据。通过观察荧光表达的范围和强度,不仅能优化病毒的注射滴度、体积和位点,还可辅助筛选适配实验需求的病毒血清型与启动子。
3.神经环路示踪
通过基因工程改造,使示踪病毒携带FP基因,就可以实现对神经环路的标记。如顺行示踪可用顺行跨单突触的AAV1,以及顺行跨多突触的单纯疱疹病毒(HSV);逆行示踪可用AAV-Retro,逆行跨多突触的伪狂犬病毒(PRV),以及结合AAV辅助病毒使用的逆行跨单突触狂犬病毒(RV)。
4.活体动态观测
结合活体显微镜技术,FP使得长期观察大脑中神经元的动态变化成为可能。例如,通过慢性颅骨窗植入并结合双光子显微镜,可在清醒自由活动或特定行为范式下,数周乃至数月内持续追踪被标记的神经元,从而研究其在学习记忆、行为决策或神经退行性疾病进展过程中的结构与功能变化。
5.功能研究的辅助定位
在实际的病毒载体构建中,研究人员常将FP基因与其他功能/目的基因(光敏通道、DREADD等)在同一个启动子控制下共表达。根据研究目的不同,主要采用两种分子策略:其一,是构建直接融合蛋白,例如“ChR2-mCherry”。此设计中,FP可直接反映功能/目的蛋白的亚细胞定位。其二,是利用“自剪切”肽序列(如P2A、T2A)连接,构建“ChR2-P2A-mCherry”等形式——翻译后两蛋白分离为独立分子,既不影响功能/目的蛋白活性,又能通过荧光勾勒细胞形态。无论采用哪种策略,实验后通过荧光定位可准确判断病毒表达区域,既确保实验结果可靠性,也为后续免疫组化分析提供关键空间依据。
选择与使用FP的实用建议
1.根据实验目的和显微镜配置选择颜色
确保您的显微镜配备了相应FP的激发光和滤光片。多色标记时,要选择光谱重叠小的FP对,如EGFP和mCherry就是经典的组合;但如果选择EGFP和YFP,两者的发射波长接近(509 nm vs 527 nm),很容易出现“串色”,导致无法区分。
2.考虑信号的强度与稳定性
对于短期观测,EGFP通常可以满足需求;但长期实验一定要选光稳定性好的FP,比如mCherry。另外,当目标蛋白表达水平较低,或者需要在深层组织中进行成像时,信号的强度就变得至关重要。在红色FP中,tdTomato和mRuby以其高亮度而著称,是检测弱信号的理想选择。
3.考虑寡聚化状态
在构建FP与目标蛋白的融合表达体系时,需重点关注FP的寡聚化状态。为避免标签干扰目标蛋白的折叠、定位及功能,单体FP是首要选择,如EGFP和mCherry,其单体特性经实验验证,可稳定用于融合表达。而tdTomato等易形成二聚体或多聚体的蛋白,可能通过聚合作用影响目标蛋白功能。
4.注意病毒载体特性
一是载体嗜性,如AAV不同血清型差异显著,直接决定了能够成功表达FP的初始细胞类型;二是载体容量,如AAV包装上限约4.7 kb,需确保FP基因及元件总长度不超限,避免影响载体包装效率与表达效果;另外还要注意启动子的选择,启动子既决定表达细胞类型,其驱动强度也有差异。对于较弱的启动子,应选择增强型、高亮度FP,避免信号过弱、难以观测。
5.合理设置对照实验
仅注射空载体(不含实验核心目的基因)的对照组对于排除FP本身及载体骨架可能对细胞产生的非特异性影响至关重要。
综合信号强度、光稳定性、光谱特性及载体兼容性等多维度考量,能更精准匹配实验需求的FP。若您在选择过程中仍有困惑,可联系我们咨询,我们可提供丰富的FP选择及配套应用建议,助力您的实验高效开展。
客户案例分享
客户文章(IF=25.5):
Li W, Zhu H, Zou X, Ye H, Zhong J, Xiang S, Lou Y, Mao J, Qi L, Hu X, Zhang Y, Hou J, Wang B, Bode C, Hoeft A, Li X, Zhang K, Colonna M, Fang X. A brain-to-lung signal from GABAergic neurons to ADRB2+ interstitial macrophages promotes pulmonary inflammatory responses. Immunity. 2025 Aug 12;58(8):2069-2085.e9. doi: 10.1016/j.immuni.2025.05.005. Epub 2025 Jun 3. PMID: 40466637.
使用我司病毒:
PRV-CMV-GFP
为揭示CeA(中央杏仁核)与肺之间的解剖学联系,研究者向野生型(WT)小鼠的肺中注射携带GFP报告基因的PRV(PRV-CMV-GFP)进行逆行跨多突触示踪,发现GFP信号依次出现在肺(30 min时)、背根神经节(DRG,48 h时)、交感神经节(72 h时)、结状-岩神经节(NPG,72 h时),并于5 d时在中枢神经系统核团RVLM(延髓头端腹外侧区)、PVH(下丘脑室旁核)和CeA中检测到,表明存在CeA-PSNs(肺交感神经)连接。
为进一步验证这种连接源自CeA γ-氨基丁酸(GABA)能神经元,团队在Gad2Cre小鼠(GABA能神经元特异性表达Cre酶)CeA区注射顺行跨单突触示踪病毒AAV1-DIO-mCherry,并结合PRV-CMV-GFP(肺内注射)进行逆行示踪,结果在CeA和RVLM均观察到mCherry与GFP信号共标,证实CeA GABA能神经元可经RVLM中继后投射至PSNs。
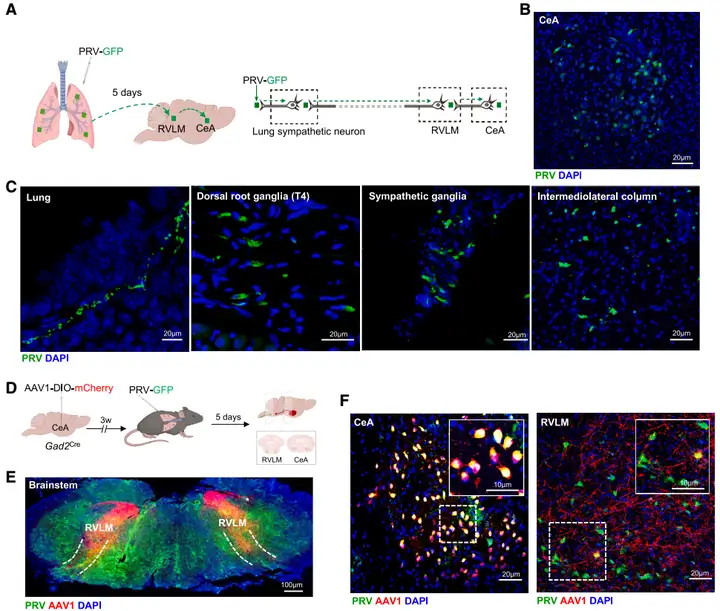
图3. CeA神经元与肺存在解剖学连接

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK