2025-11-17 阅读量:355
过去,L-乳酸曾被认为是葡萄糖代谢的废物副产品。但越来越多的证据表明,在神经系统、肿瘤微环境、肠道菌群和免疫系统中,L-乳酸既作为能量来源,也作为信号分子,发挥着多种重要作用。这些作用对生理和病理过程产生影响。若能拥有一套基因编码荧光探针,实现对细胞外和细胞内空间中L-乳酸的高分辨率时空动态成像,将为研究L-乳酸在细胞和组织中新兴的作用提供便利。然而,目前针对L-乳酸的细胞间和细胞内动态变化的研究,仍因L-乳酸特异性基因编码探针的选择有限且性能不足而受阻。
近期,日本东京大学研究团队在Nature Communications期刊(IF=16.6)发表题为“Lactate biosensors for spectrally and spatially multiplexed fluorescence imaging”的研究论文。该研究中,作者报道了一对光谱和功能上正交的高性能基因编码探针:一种是绿色荧光细胞外L-乳酸探针(命名为eLACCO2.1),另一种是红色荧光细胞内L-乳酸探针(命名为R-iLACCO1)。eLACCO2.1具有优异的膜定位能力和稳定的荧光响应。R-iLACCO1及其亲和力变体的荧光响应,比以往报道的任何一种细胞内L-乳酸探针都更强。研究人员通过在培养细胞中共表达eLACCO2.1和R-iLACCO1,实现了L-乳酸动态变化的光谱和空间多重成像;同时,也在小鼠体内实现了细胞外和细胞内L-乳酸动态变化的成像。

1.第二代绿色荧光L-乳酸探针eLACCO2.1的研发
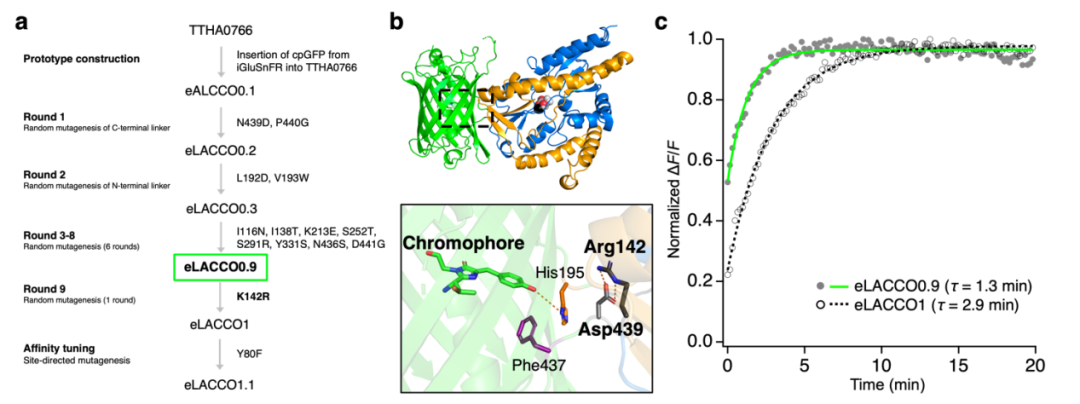
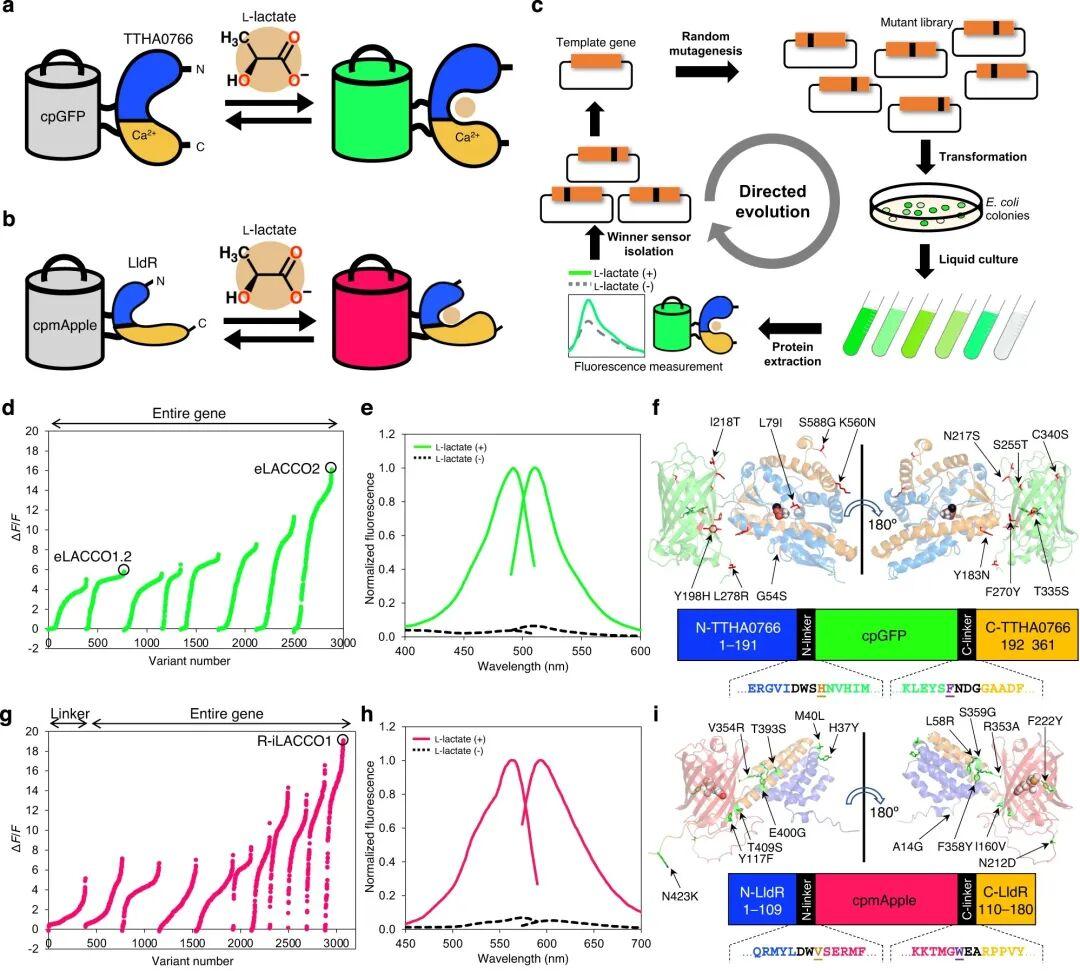
为研发第二代绿色荧光细胞外L-乳酸探针,作者发现eLACCO0.9是极具潜力的候选分子——其荧光响应速度快于eLACCO1(初代版本)。为获得经L-乳酸处理后荧光强度变化率[ΔF/F=(最大荧光强度Fmax-最小荧光强度Fmin)/最小荧光强度Fmin]更高的eLACCO0.9突变体,研究人员通过筛选粗蛋白提取物的ΔF/F值开展定向进化。前两轮进化采用对eLACCO0.9全长基因进行随机突变构建的文库(原始ΔF/F=3.9),最终获得ΔF/F=5.8的eLACCO1.2。为避免二硫键形成可能引发的潜在问题,引入Cys340Ser突变,得到eLACCO1.3(粗蛋白提取物ΔF/F=4.8)。经额外六轮定向进化后,成功获得ΔF/F=16的eLACCO2突变体。
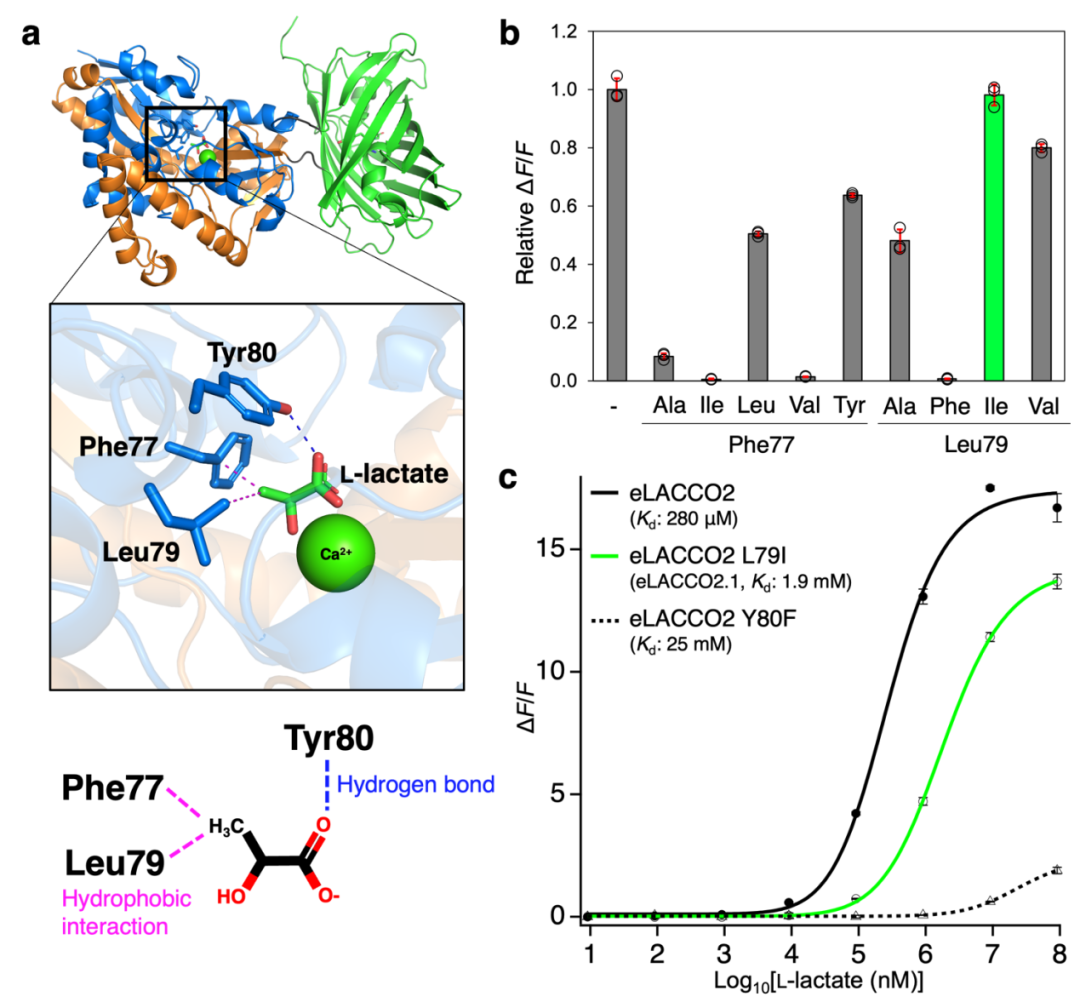
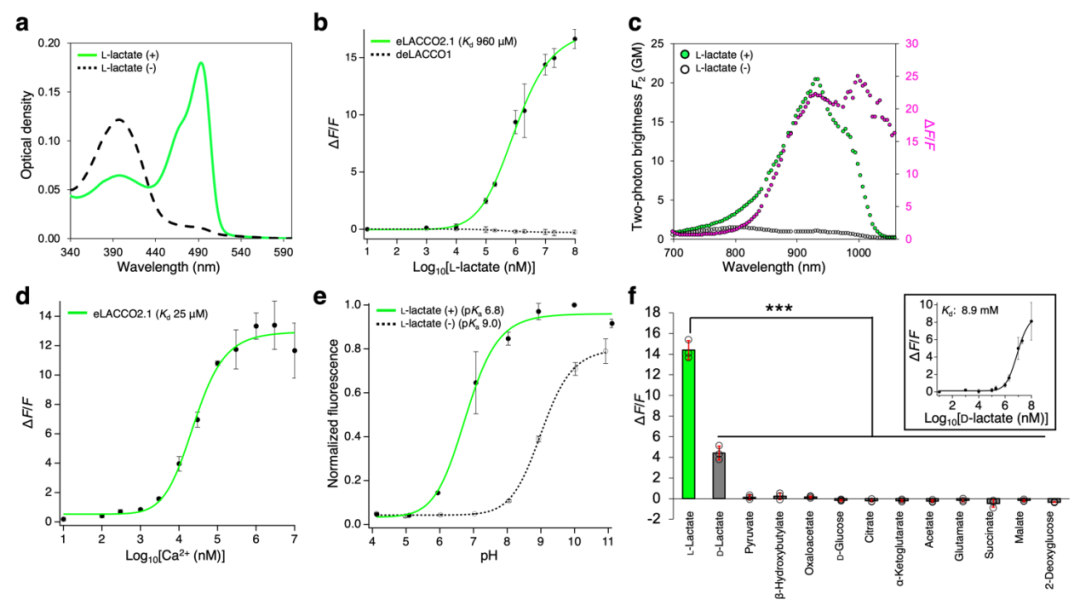
对纯化后eLACCO2的表征结果显示,其对L-乳酸的亲和力(对应表观解离常数Kd≈280 μM)过强,Kd值远低于细胞外L-乳酸的典型浓度(mM级)。为优化其对细胞外L-乳酸的亲和力,对L-乳酸结合口袋中的氨基酸残基进行突变。在测试的10个突变体中,Leu79Ile突变体(命名为eLACCO2.1)表现出更低的亲和力(表观Kd=1.9 mM),且相较eLACCO2,其ΔF/F值仅略有下降。经10 mM L-乳酸处理后,纯化后eLACCO2.1 ΔF/F值为14,是eLACCO1.1的3.5倍,且相较于eLACCO0.9存在13个突变位点。研究人员还构建了无响应对照探针deLACCO1:首先在eLACCO2中引入Asp444Asn突变以阻断L-乳酸结合,随后经三轮定向进化提升其荧光亮度。接下来,作者对可溶性形式的eLACCO2.1进行了全面表征。
图1.eLACCO0.9的响应速度快于eLACCO1
图2.亲和力优化的eLACCO2.1开发
图3.eLACCO2.1和R-iLACCO1的开发
图4.eLACCO2.1的体外表征
2.细胞内L-乳酸红色荧光探针R-iLACCO1的研发
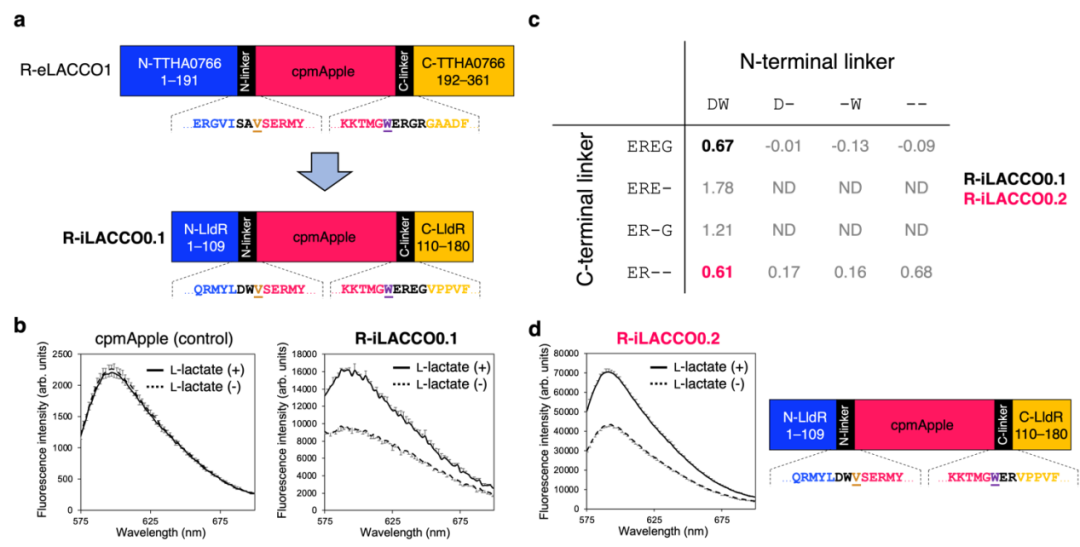
为构建红色荧光L-乳酸探针,研究者将源自嗜热栖热菌TTHA0766蛋白(L-乳酸结合蛋白)的红色荧光L-乳酸探针R-eLACCO1(作者团队此前开发)的环状重排红色荧光蛋白(cpmApple),插入大肠杆菌(E.coli)LldR蛋白(L-乳酸脱氢酶调节蛋白,能特异性识别L-乳酸并发生构象变化)的L-乳酸结合结构域(LBD)第109位。与依赖Ca2+的TTHA0766相比,LldR不依赖Ca2+,且能在Ca2+浓度较低(≈0.1-1 mM)的细胞质基质中发挥功能。所得突变体命名为R-iLACCO0.1,其荧光较暗,经L-乳酸处理后荧光强度仅轻微升高(粗蛋白提取物ΔF/F=0.7)。
为优化R-iLACCO0.1,研究人员对连接cpmApple与LldR的连接肽长度进行了调整,发现删除C端连接肽中2个氨基酸的突变体(命名为R-iLACCO0.2)荧光亮度显著提升,同时保留了相当的荧光响应(粗蛋白提取物ΔF/F=0.6)。为获得ΔF/F值更高的R-iLACCO0.2突变体,先进行一轮C端连接肽优化,随后通过全长基因随机突变开展十轮定向进化。最终成功获得纯化蛋白ΔF/F=20的R-iLACCO1。相较于R-iLACCO0.1,R-iLACCO1共包含16个突变位点。
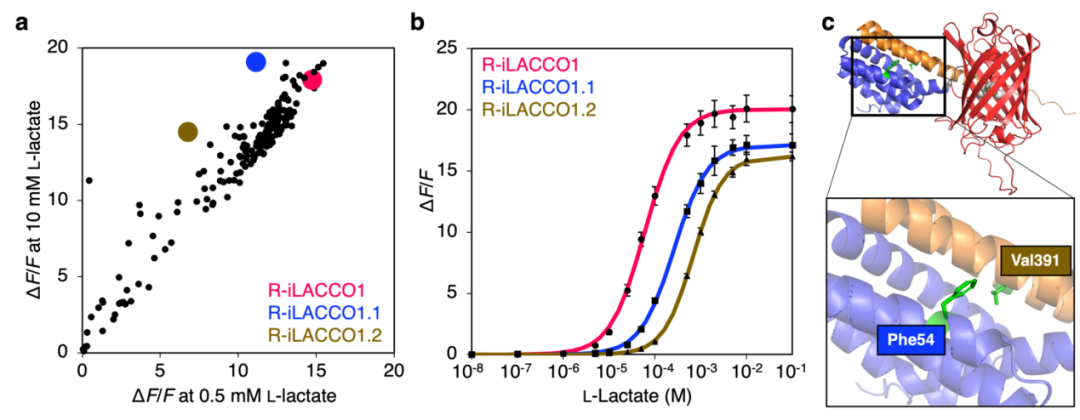
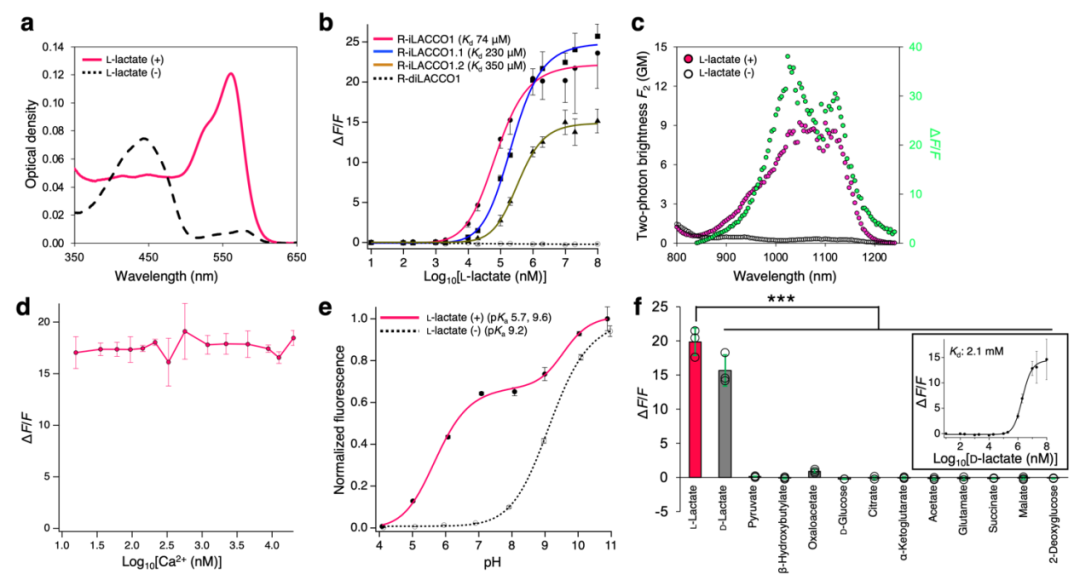
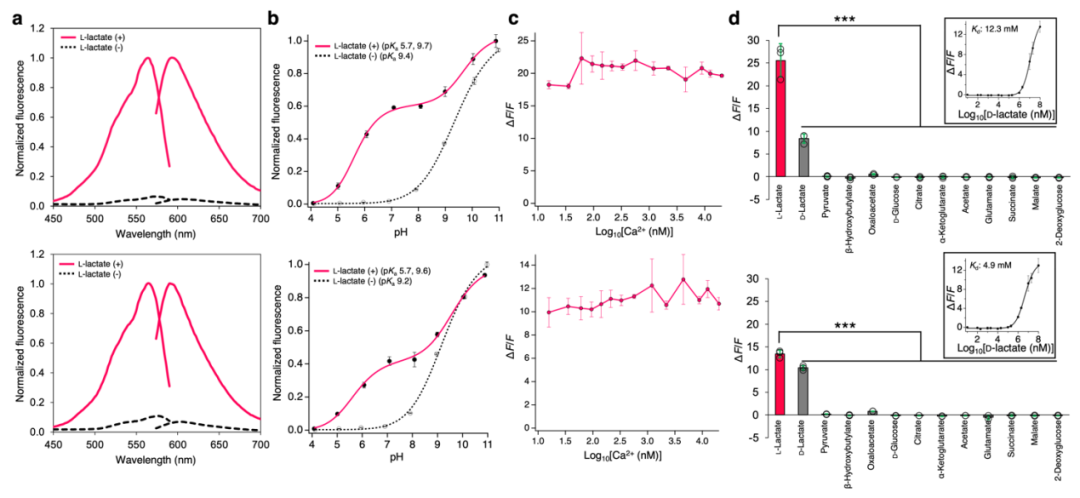
鉴于细胞内L-乳酸的生理浓度范围较广,研究者进一步研发了R-iLACCO1的低亲和力突变体。在定向进化最后一轮中,对所有随机挑选的突变体分别在无L-乳酸、0.5 mM L-乳酸及10 mM L-乳酸条件下进行筛选,以评估其表观Kd值,最终筛选得到两个低亲和力突变体,分别命名为R-iLACCO1.1和R-iLACCO1.2。研究人员同样构建了无响应对照探针R-diLACCO1:首先在R-iLACCO1中引入Asp69Asn突变以阻断L-乳酸结合,随后经两轮定向进化提升其荧光亮度。接下来对R-iLACCO1及其亲和力突变体的生化特性与光谱特性进行了详细表征。
图5.R-iLACCO原型的构建
图6.L-乳酸低亲和力R-iLACCO系列突变体的开发
图7.R-iLACCO1的体外表征
图8.R-iLACCO1.1与R-iLACCO1.2的体外表征
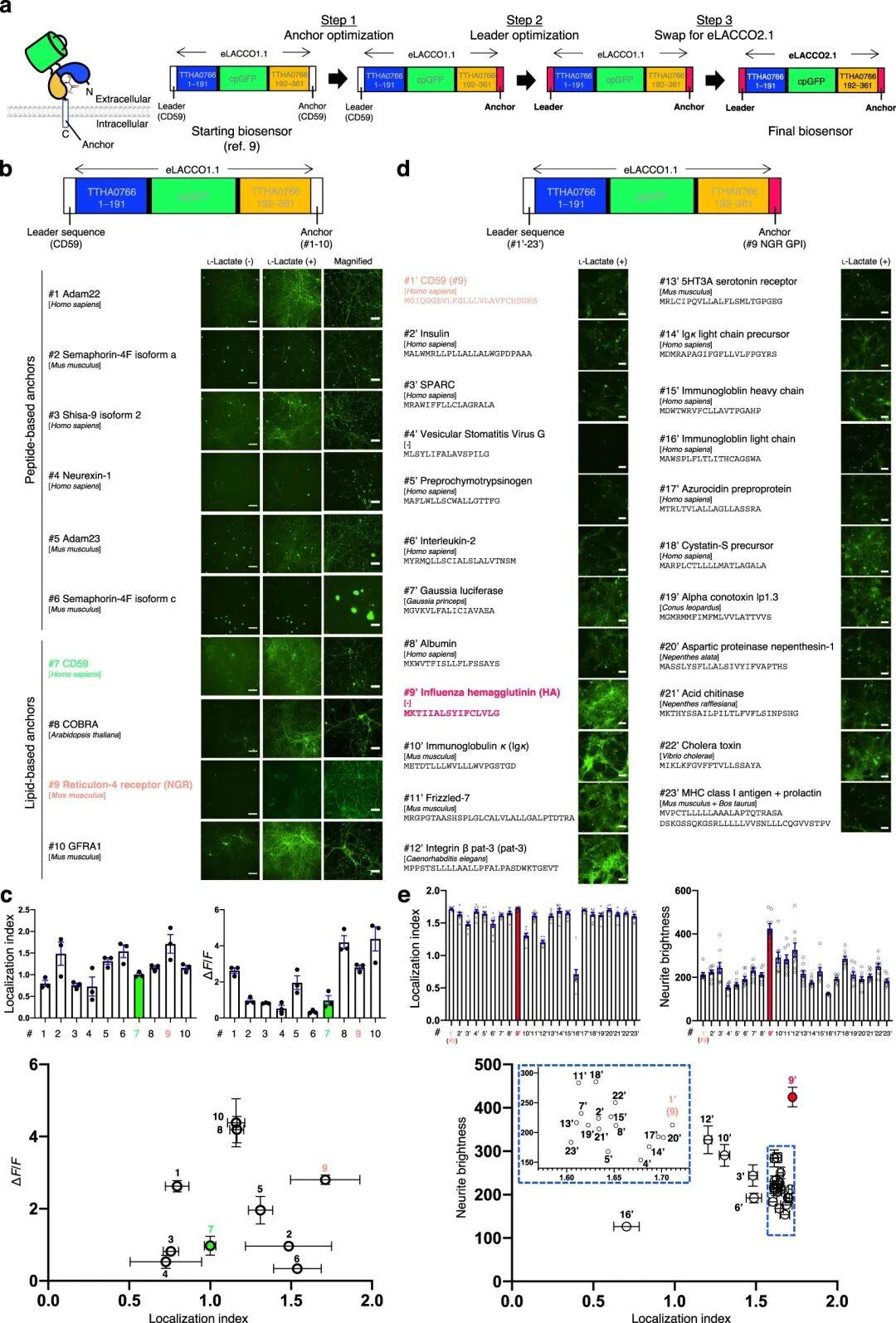
3.细胞表面定位优化
作者此前针对eLACCO1.1和R-eLACCO2的研究已证实,N端信号肽序列与C端锚定结构域的特定组合,在决定特定细胞外探针的细胞表面靶向效率及其功能活性方面发挥关键作用。为筛选出适用于大鼠原代神经元的最优组合,将23种信号肽和10种锚定结构域与eLACCO1.1进行组合评估。
首先,研究人员以人源CD59衍生的信号肽序列为基础,搭配10种不同的锚定结构域[包括肽基锚定结构域和脂质(糖基磷脂酰肌醇,GPI)基锚定结构域],考察细胞表面靶向效率。荧光成像结果显示,相较于原始构建体CD59-eLACCO1.1-CD59(同时利用CD59的N端信号肽及C端GPI锚定结构域),网状蛋白-4受体(Nogo受体,NGR)GPI锚定结构域不仅使细胞表面定位效率最高,还展现出更高的ΔF/F。随后,在L-乳酸存在的条件下,筛选了多种N端信号肽序列与NGR锚定结构域的组合。在测试的23种信号肽序列中,流感血凝素(HA)不仅实现了良好的膜定位,且在神经突起中展现出比CD59-eLACCO1.1-NGR更强的荧光信号。确定HA与NGR为细胞表面靶向的最优组合后,将这些序列附加到eLACCO2.1上,获得最终构建体HA-eLACCO2.1-NGR,并将其用于所有细胞成像实验。
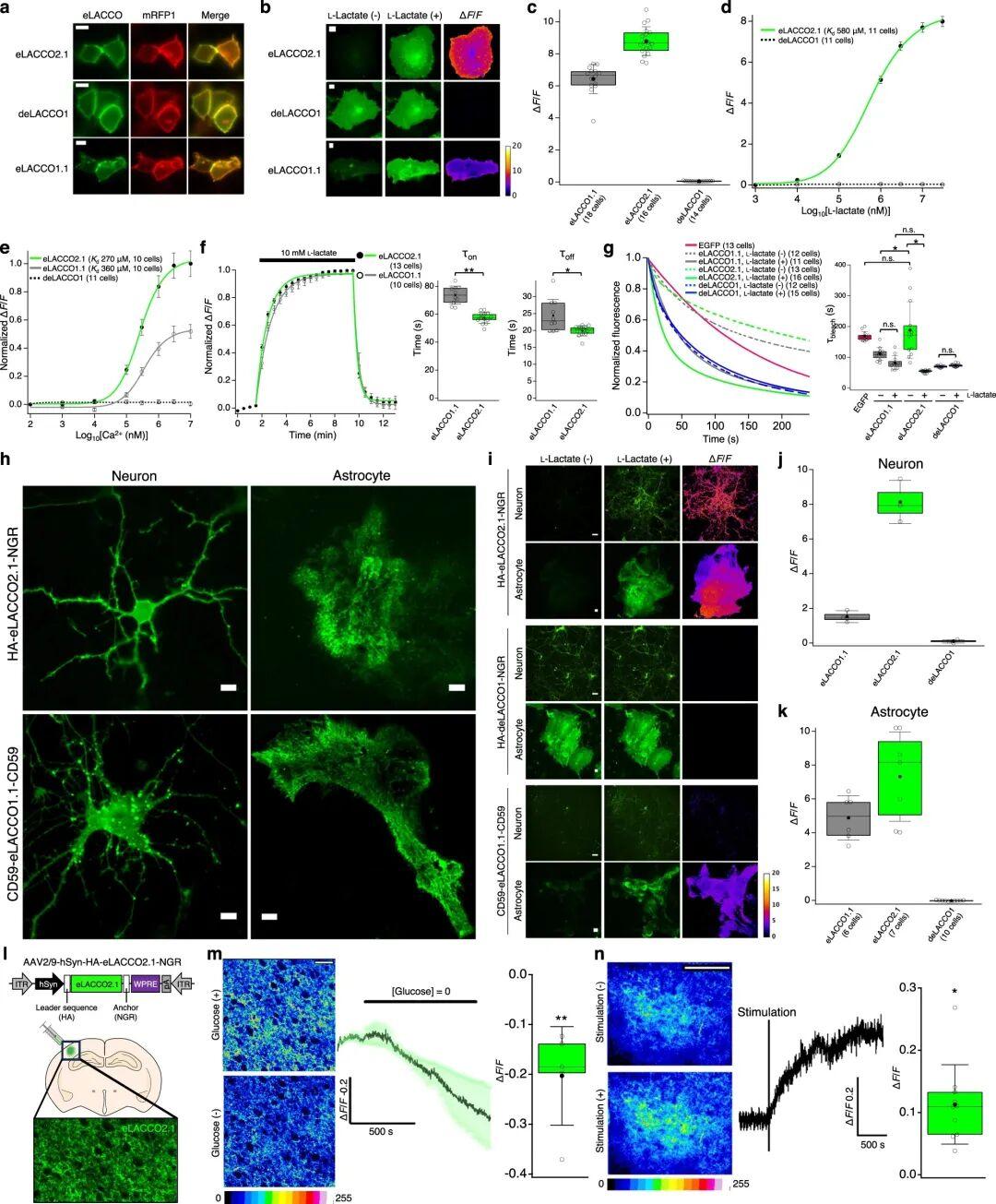
4.eLACCO2.1在哺乳动物细胞及急性脑切片中的表征
研究人员在哺乳动物细胞(人胚肾细胞HEK293T)中表达并表征了HA-eLACCO2.1-NGR。结果显示,eLACCO2.1在细胞膜上定位良好。向表达eLACCO2.1的HeLa细胞(人宫颈癌细胞)施加10 mM L-乳酸后,其荧光强度显著升高(ΔF/F=8.8±0.2),该响应值为eLACCO1.1(ΔF/F=6.4±0.2)的138%。对照探针deLACCO1膜定位效果良好,且如预期所示,对L-乳酸无响应。eLACCO2.1对L-乳酸的原位表观Kd为580 μM。与eLACCO1.1类似,eLACCO2.1表现出Ca2+依赖性荧光,其原位表观Kd为270 μM,远低于脑组织(1.5-1.7 mM)和血清(0.9-1.3 mM)中的细胞外Ca2+浓度。
为评估eLACCO2.1的响应动力学,研究者将表达eLACCO2.1的HeLa细胞依次暴露于含0 mM、10 mM及0 mM L-乳酸的溶液中。结果显示,eLACCO2.1的结合速率(τon=57±4 s)和解离速率(τoff=20±2 s)均快于eLACCO1.1(τon=74±7 s,τoff=24±5 s)。在无L-乳酸存在时,eLACCO2.1的光稳定性(光漂白时间常数τbleach=189±26 s)与EGFP(τbleach=169±4 s)相当,且高于eLACCO1.1(τbleach=111±6 s);而在有L-乳酸存在时,其光稳定性(τbleach=55±1 s)低于eLACCO1.1(τbleach=83±7 s)。无论有无L-乳酸,deLACCO1的光稳定性均低于EGFP(有L-乳酸时τbleach=74±1 s,无L-乳酸时τbleach=70±1 s)。
为表征eLACCO2.1在神经元表面的性能,研究人员在人源突触蛋白1(hSyn)启动子调控下,将其在大鼠原代神经元中表达。结果显示,HA-eLACCO2.1-NGR在神经元中呈现明亮的膜定位荧光,而CD59-eLACCO1.1-CD59的膜定位荧光中存在部分斑点。给予10 mM L-乳酸后,eLACCO2.1的ΔF/F值为8.1±0.7,是eLACCO1.1(ΔF/F=1.5±0.2)的5.4倍。
为验证eLACCO2.1能否检测星形胶质细胞表面的L-乳酸浓度变化,研究者在GfaABC1D启动子调控下,将其在大鼠原代星形胶质细胞中表达。该探针表达效果良好,给予10 mM L-乳酸后,其ΔF/F值为7.3±1.0,较eLACCO1.1(ΔF/F=4.9±0.5)显著提升。与HeLa细胞和神经元中的结果一致,deLACCO1对L-乳酸无响应。综上,这些结果表明,经信号肽和锚定结构域优化的eLACCO2.1,其性能较eLACCO1.1显著提升,可用于神经元和星形胶质细胞表面细胞外L-乳酸浓度动态变化的成像检测。
为明确eLACCO2.1能否检测完整组织中内源性L-乳酸的浓度变化,作者通过腺相关病毒(AAV)将hSyn启动子调控的HA-eLACCO2.1-NGR递送至小鼠新皮层(这里指躯体感觉皮层),使其在神经元表面表达。在脑切片的体外培养环境中,无糖刺激(即葡萄糖耗竭)导致eLACCO2.1的荧光强度下降(ΔF/F=-0.20±0.04),该响应与细胞对可利用的细胞外L-乳酸的摄取过程一致。已有研究报道,高频传入电刺激会升高神经元周围的细胞外L-乳酸浓度。研究人员实验证实,θ爆发式刺激(θ脉冲)可显著增强eLACCO2.1的信号,且记录15分钟后该信号仍未消退(ΔF/F=0.11±0.02)。综上,这些结果表明,eLACCO2.1能够检测完整组织中内源性细胞外L-乳酸的浓度变化。
图10.eLACCO2.1在哺乳动物细胞及急性脑切片中的表征
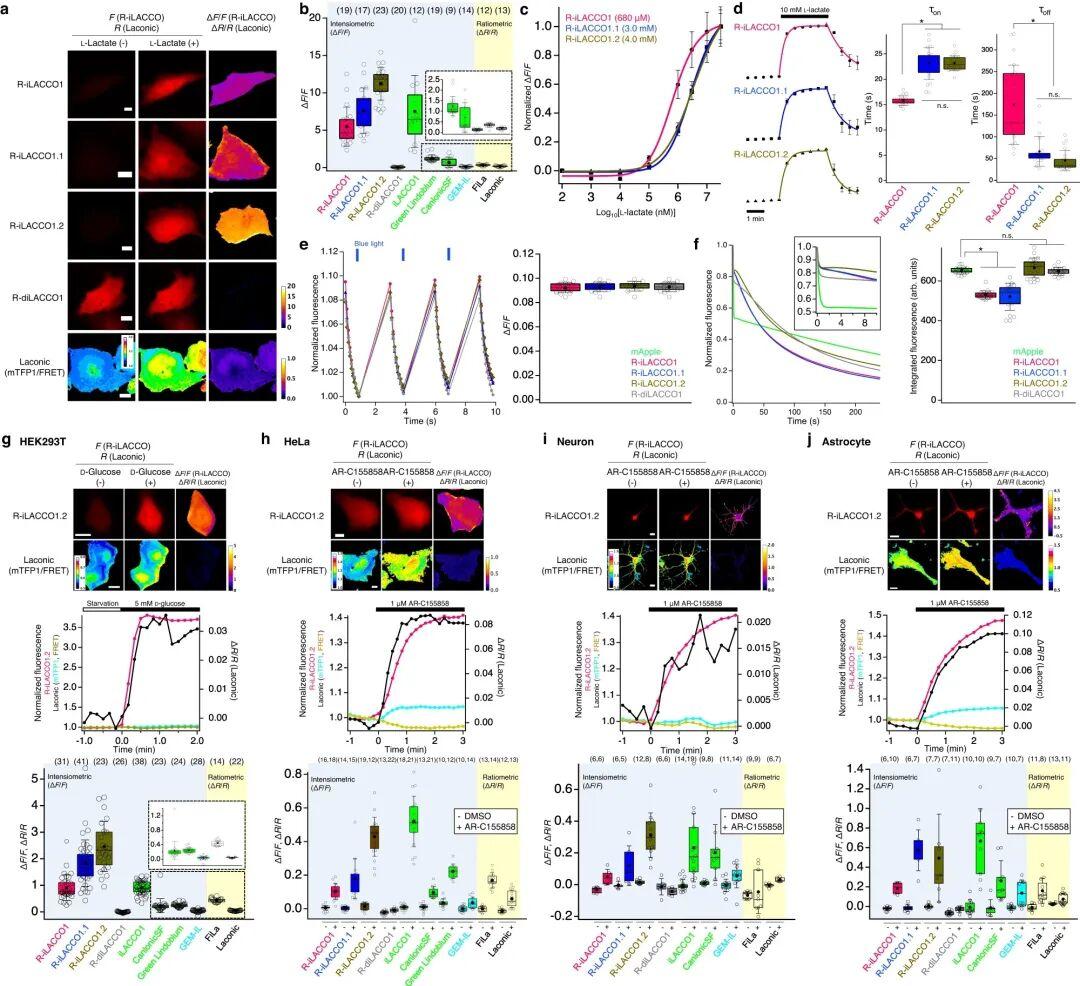
5.R-iLACCO1在哺乳动物细胞中的表征
接下来,研究人员在哺乳动物细胞中表达了R-iLACCO系列突变体,并与先前报道的细胞内L-乳酸探针(Laconic等)进行对比表征。向表达R-iLACCO亲和力突变体的HeLa细胞施加L-乳酸后,其荧光强度均显著升高(R-iLACCO1、R-iLACCO1.1、R-iLACCO1.2的ΔF/F分别为5.5±0.6、7.6±0.7、11±0.5)。相同条件下,对照探针R-diLACCO1对L-乳酸无响应。R-iLACCO1、R-iLACCO1.1、R-iLACCO1.2对L-乳酸的原位表观Kd分别为680 μM、3.0 mM、4.0 mM。施加L-乳酸后结果显示,R-iLACCO1.1(τon=23.1±0.7 s,τoff=66.5±7.5 s)和R-iLACCO1.2(τon=23.2±0.3 s,τoff=45.4±5.1 s)的结合速率慢于R-iLACCO1(τon=15.8±0.2 s,τoff=174±21 s),而解离速率快于R-iLACCO1。
许多基于cpmApple的探针经蓝光照射后会发生光激活现象,这阻碍了其与GCaMP、通道视紫红质(ChR)等蓝光响应工具的联合使用。作者发现,用蓝光(470 nm波长下强度约10 mW/cm2)照射HeLa细胞中的R-iLACCO系列突变体时,其荧光强度仅轻微升高(ΔF/F≈0.09)。该结果表明,R-iLACCO系列突变体的光激活与恢复过程动力学速率更快,且其ΔF/F远小于L-乳酸依赖性荧光响应的最大值。为评估R-iLACCO系列突变体的光稳定性,采用HeLa细胞中的积分荧光强度(IF)作为检测指标(而非τbleach),这更能反映基于mApple的探针复杂的光漂白衰减过程。R-iLACCO1.2和R-diLACCO1的光稳定性(IF分别为666±50、650±20)与mApple(IF=653±17)相当;而R-iLACCO1和R-iLACCO1.1的光稳定性(IF分别为530±20、520±68)低于mApple。
为探究R-iLACCO系列突变体是否能实现对哺乳动物细胞内源性L-乳酸动态变化的监测,在多种细胞类型及刺激条件下对其进行了活细胞成像,并与先前报道的L-乳酸探针进行平行对比。对葡萄糖饥饿的HEK293T细胞进行葡萄糖处理,可促进其糖酵解过程,进而导致细胞内L-乳酸浓度升高,R-iLACCO系列突变体的荧光强度也随之相应升高。值得注意的是,低亲和力突变体R-iLACCO1.2在所有R-iLACCO突变体中荧光响应最强,其ΔF/F值(2.5±0.2)远大于其他L-乳酸探针的ΔF/F值或比率变化值ΔR/R。
抑制单羧酸转运蛋白(MCT)的功能,可抑制细胞内L-乳酸的外排,从而导致细胞内L-乳酸浓度升高。用MCT抑制剂AR-C155858处理HeLa细胞后,R-iLACCO系列突变体均引发显著的荧光变化(R-iLACCO1、R-iLACCO1.1、R-iLACCO1.2的ΔF/F值分别为0.10±0.01、0.18±0.03、0.43±0.02)。低亲和力突变体R-iLACCO1.2的ΔF/F值高于除iLACCO1(作者团队已开发的绿色荧光细胞内L-乳酸探针)外的所有其他L-乳酸探针。为验证R-iLACCO系列突变体在神经细胞中的功能,对原代神经元和星形胶质细胞进行了荧光成像。用AR-C155858处理神经元和星形胶质细胞后,R-iLACCO系列突变体的荧光强度均显著升高。
细胞内L-乳酸浓度升高会伴随胞内pH下降,而这可能导致基于荧光蛋白(FP)的探针荧光强度降低。然而,在所有检测的成像条件下,响应于细胞内L-乳酸水平的升高,R-iLACCO系列突变体均表现出显著的荧光强度升高。综上,这些结果表明,R-iLACCO系列突变体特别适用于哺乳动物细胞胞内L-乳酸浓度动态变化的成像检测。
图11.R-iLACCO系列突变体在哺乳动物细胞中的表征
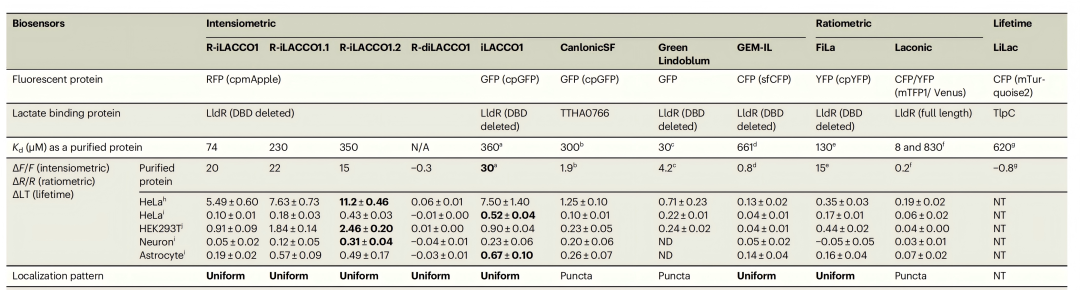
表1.细胞内L-乳酸探针性能对比
6.eLACCO2.1与R-iLACCO1.1在小鼠体内的成像表征
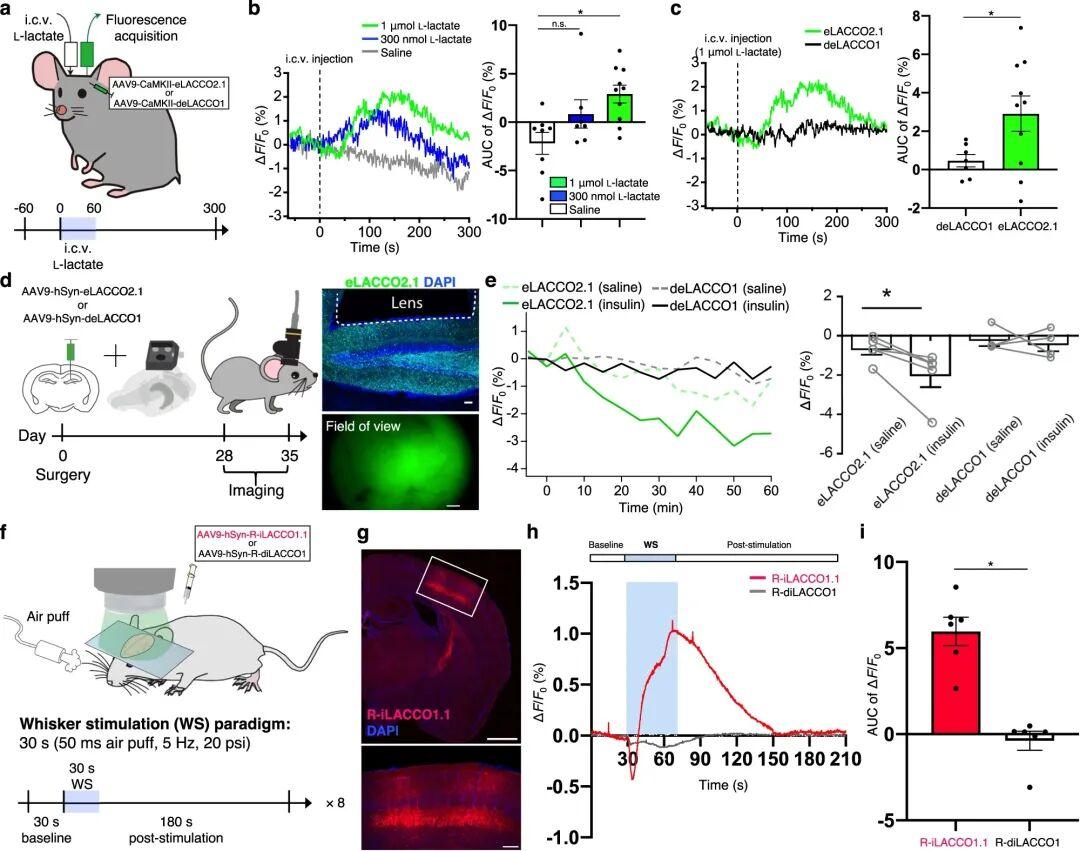
为验证eLACCO2.1的体内性能,研究人员在清醒小鼠的视觉皮层神经元中表达该探针,并在侧脑室内(i.c.v.)注射L-乳酸后检测其荧光响应。与生理盐水对照组相比,eLACCO2.1对L-乳酸表现出显著的荧光响应,而对照探针deLACCO1的荧光强度几乎无变化。这些结果表明,eLACCO2.1在体内可作为功能性细胞外L-乳酸探针发挥作用。
接下来,研究者旨在验证eLACCO2.1能否检测自由活动小鼠体内内源性L-乳酸的动态变化。已有研究报道,系统性注射胰岛素会导致小鼠脑组织中细胞外L-乳酸浓度降低。于是,研究人员在海马神经元中表达eLACCO2.1,并在腹腔内(i.p.)注射胰岛素后记录其荧光响应。与生理盐水处理组相比,胰岛素处理后eLACCO2.1的荧光强度显著降低;此外,deLACCO1的荧光强度无明显变化。因此,eLACCO2.1能够检测自由活动小鼠体内内源性L-乳酸的动态变化。
已有研究报道,刺激小鼠胡须会诱发其躯体感觉皮层神经元内L-乳酸浓度升高。为探究R-iLACCO系列探针能否在体内监测细胞内L-乳酸的动态变化,作者在躯体感觉皮层神经元中表达R-iLACCO1.1,并观察胡须刺激后(空气气流刺激)的荧光响应。对浅麻醉小鼠的荧光成像结果显示,R-iLACCO1.1表现出刺激依赖性荧光响应,信号呈逐渐升高趋势。这些结果表明,R-iLACCO1.1可用于监测小鼠体内内源性L-乳酸的动态变化。
图12.小鼠体内L-乳酸成像
7.胶质母细胞瘤细胞中L-乳酸的光谱与空间多重成像
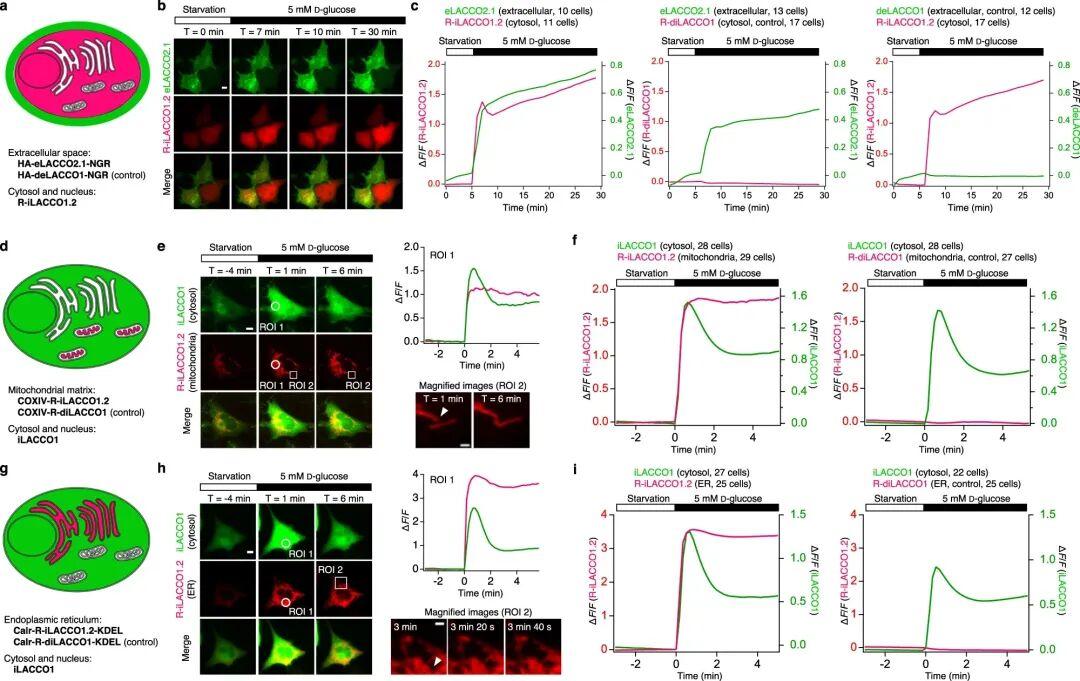
为直接观察细胞质基质中L-乳酸的生成及其向细胞外间隙的转运,研究人员在饥饿的胶质母细胞瘤细胞(人脑胶质瘤细胞T98G)中共表达了eLACCO2.1(用于细胞外L-乳酸成像)和R-iLACCO1.2(用于细胞内L-乳酸成像)。葡萄糖刺激诱发了两种探针的同步荧光强度升高,这表明细胞质基质中生成的L-乳酸会快速转运至细胞外间隙。值得注意的是,细胞内L-乳酸信号出现了一个瞬时峰值,而此时细胞外L-乳酸信号的斜率显著变小。考虑到在MCT抑制剂存在时,研究人员几乎未观察到这一瞬时峰值,推测该峰值是由细胞质基质中L-乳酸的生成与经MCT介导的外排之间的平衡所导致。
为探究L-乳酸是否会在细胞质基质与细胞器之间转运,作者接下来监测了线粒体基质和内质网(ER)中的L-乳酸动态变化。在饥饿的T98G细胞中将R-iLACCO1.2靶向定位至线粒体基质或ER[将探针融合酵母来源的细胞色素c氧化酶亚基IV(COXIV)蛋白N端信号肽序列,将其靶向线粒体基质;将探针融合人钙网蛋白(Calr)N端信号肽序列(介导探针进入ER腔),将其靶向ER,同时融合该蛋白C端的KDEL序列,让探针滞留在ER腔中],并共表达细胞质基质定位的iLACCO1。葡萄糖处理后,线粒体基质和ER中R-iLACCO1.2的荧光强度均随iLACCO1的荧光强度同步升高。这些结果表明,细胞质基质中生成的L-乳酸除了转运至细胞外间隙外,还会转运至线粒体基质和ER。
图13.光谱与空间多重L-乳酸成像
总结
综上,该团队开发了改进型绿色荧光细胞外L-乳酸探针eLACCO2.1,以及红色荧光细胞内L-乳酸探针R-iLACCO1。该LACCO系列探针将为以光谱与空间多重成像的方式,探究L-乳酸的新兴作用提供新契机。
我司可提供eLACCO2.1、R-iLACCO1.2病毒产品,列表如下:


详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK