2025-10-27 阅读量:303
钾离子(K⁺)是维持生命活动不可或缺的关键离子,它不仅是神经元动作电位产生与静息膜电位维持的核心离子——哺乳动物静息状态下细胞内K⁺浓度(142-175 mM)远高于细胞外(3.5-5 mM),这使得静息膜电位维持在-70至-80 mV之间,为神经信号的正常传递奠定基础;还被星形胶质细胞通过“K⁺缓冲”过程调控细胞外K⁺浓度水平,以避免神经元过度兴奋,维持整体离子稳态。因此,在生理浓度下具有高动态范围的灵敏离子探针对于准确分析K⁺稳态及其功能瞬变至关重要。然而,传统的检测手段(如离子敏感电极、荧光染料)存在空间分辨率低、侵入性强、离子选择性差、动态范围有限、难以靶向特定细胞类型或亚细胞结构等固有局限性,极大地阻碍了相关研究的进展。
随着基因工程技术的发展,基因编码K⁺指示剂(GEPOs)成为新的研究方向——允许以高空间和时间分辨率进行实时、微创监测。目前已有的GEPOs中,基于福斯特共振能量转移(FRET)技术的指示剂(如GEPII、KIRIN1s)虽能提供比率型输出信号以提高测量准确性,但需双发射色带,限制了多通道成像应用,且普遍存在信号弱、动态范围有限的问题;而基于单一荧光蛋白(FP)的指示剂虽更难设计,但仅需单色系激发和发射,且通常具有更高的动态范围和更强的信号。基于单一绿色FP(GFP)的指示剂(如GINKO1、GINKO2、KRaIONs)已成功应用于监测哺乳动物细胞和植物细胞内K⁺动态变化。与GFP相比,红色FP具有组织穿透更深、光毒性更低的优势,且与多种现有绿色指示剂(如钙指示剂GCaMP)兼容。因此,开发红色GEPOs(RGEPOs)对于推进K⁺相关研究至关重要。
2025年9月17日,西湖大学生命科学学院/西湖实验室Kiryl D. Piatkevich助理教授课题组与国内外多家科研机构合作研究,在PLoS Biology发表了题为“Sensitive red fluorescent indicators for real-time visualization of potassium ion dynamics in vivo”的研究论文,成功开发出两种新型RGEPOs——RGEPO1与RGEPO2。该研究将从热液喷口细菌中克隆的K⁺结合蛋白(Hv-Kbp)插入红色FP mApple的特定位点(靠近发色团的第7个β链处),并通过“大肠杆菌定向进化+哺乳动物细胞(HEK293FT)优化”的双重策略,最终获得两种功能互补的指示剂:RGEPO1定位于细胞膜外侧,适用于检测细胞外K⁺;RGEPO2定位于细胞质,适用于检测细胞内K⁺。这两种指示剂在生理相关的K⁺浓度范围内表现出高灵敏度、良好的选择性以及完全可逆的荧光响应。研究团队进一步在培养神经元、星形胶质细胞、急性脑切片以及清醒小鼠体内验证了RGEPOs的功能,首次实现了对清醒小鼠癫痫发作期间细胞内与细胞外K⁺瞬变的可视化观察;同时通过分子动力学模拟,揭示了两种指示剂不同的K⁺结合口袋结构与结合机制,为其选择性与敏感性提供了分子层面的解释。RGEPO1/2的开发填补了RGEPOs的空白,为在复杂生物系统中研究K⁺动态变化提供了全新的高性能工具。
枢密科技重磅推出红色荧光K⁺成像利器——RGEPO1与RGEPO2!前者膜定位可精准监测胞外K⁺动态,后者胞质定位能捕捉胞内K⁺变化,均具备高特异性、可逆性响应及宽浓度检测范围,且兼容现有绿色指示剂(如GCaMP)实现双色同步成像,为癫痫等K⁺失衡疾病机制研究、神经活动中离子动态关联解析提供高性能工具。选择枢密科技,解锁K⁺动态监测新维度!相关产品见文末~
1、RGEPOs的研发与验证
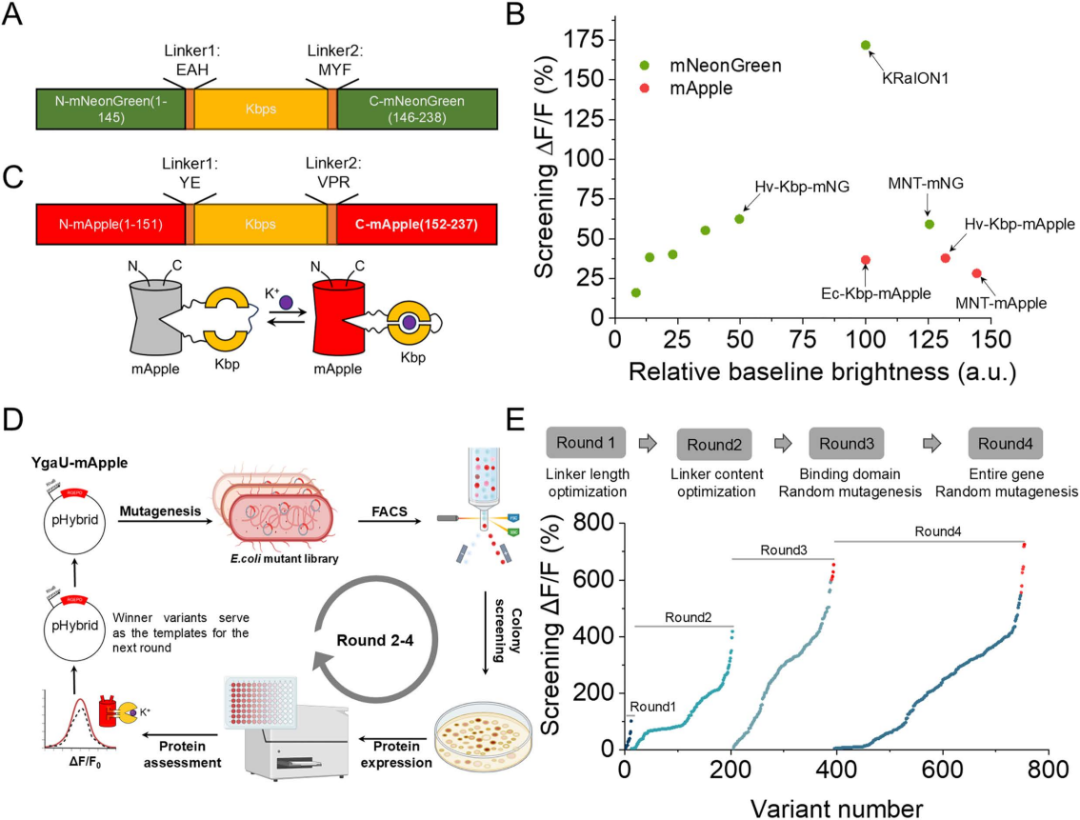
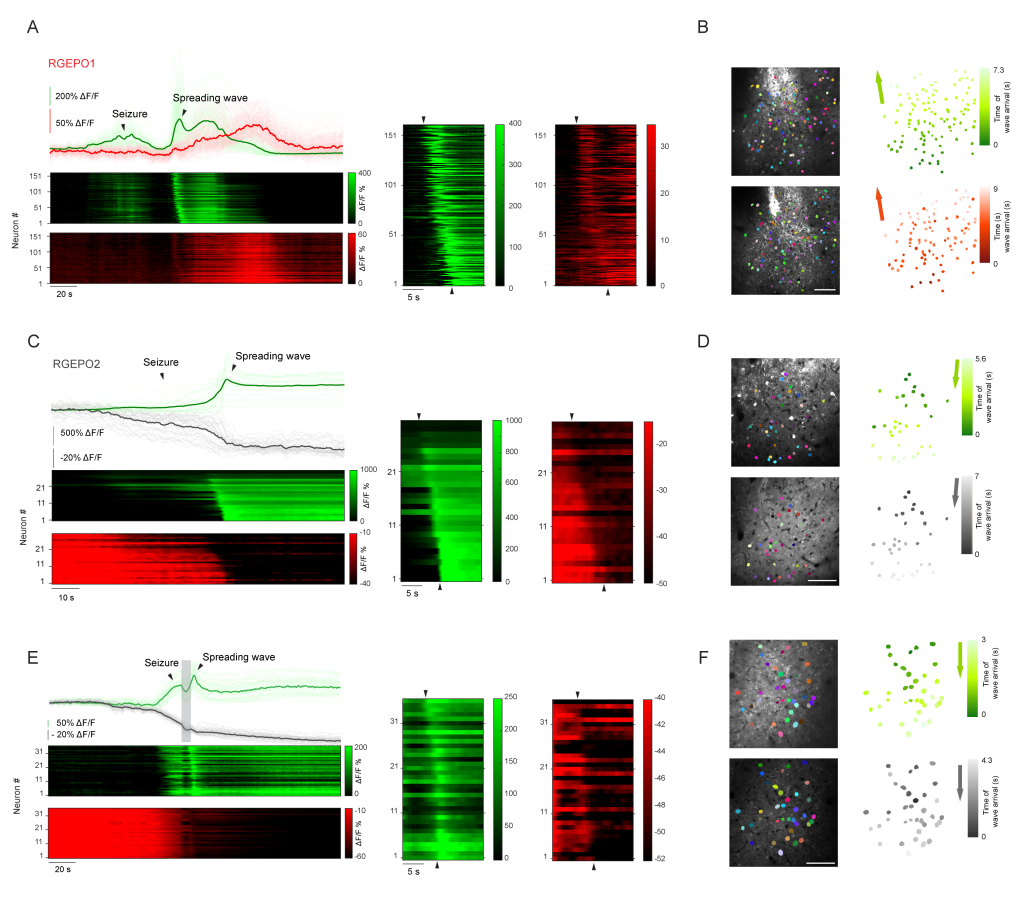
为开发基于单一红色FP的K⁺指示剂,研究团队以已知K⁺结合蛋白Hv-Kbp为模板,通过基因组挖掘技术筛选出5种同源候选蛋白(与Hv-Kbp氨基酸同源性为40%-70%,含保守K⁺结合位点)。随后,研究团队将KRaION1指示剂(一种已报道的绿色GEPOs)中的Ec-Kbp(大肠杆菌来源的钾离子结合蛋白)替换为上述同源蛋白(包括Hv-Kbp),并在大肠杆菌中表达验证。结果表明,其中Hv-Kbp与MNT的荧光变化(ΔF/F)及基线亮度最优,因此与Ec-Kbp共同作为开发RGEPOs的候选结合结构域。接下来,研究团队将三者分别嵌入红色FP mApple的特定位点,并在大肠杆菌中表达验证。综合亮度与响应幅度,选取Hv-Kbp嵌合体进行进一步改造:通过大肠杆菌高通量筛选优化连接肽;再经随机突变获得ΔF/F超600%的变体。
图1. 红色K⁺生物传感器在大肠杆菌中的研发与优化
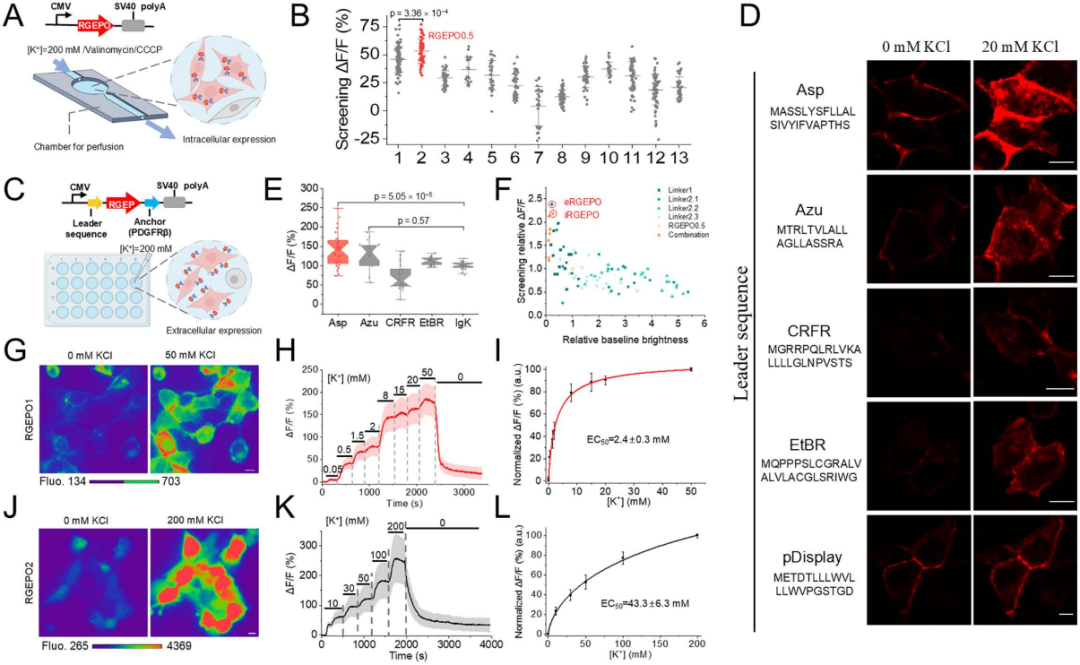
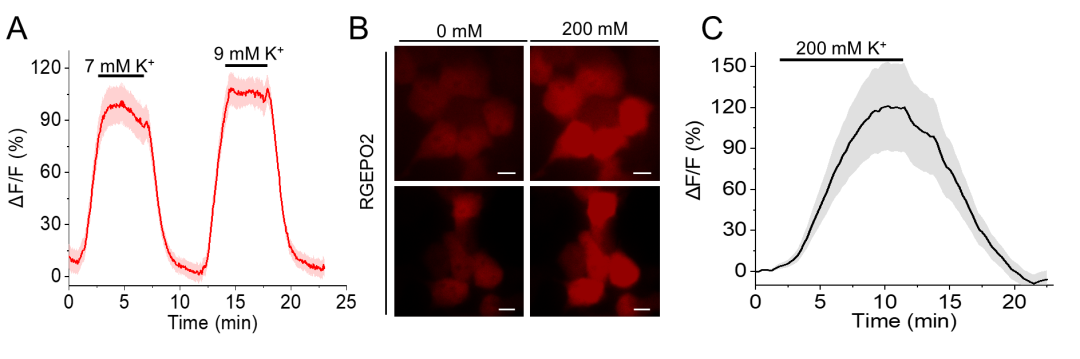
由于传感器在体外溶液体系中的性能无法直接迁移至哺乳动物细胞,团队将最优变体在HEK293FT细胞(人胚肾细胞)中进行验证,发现其ΔF/F仅为溶液中的1/13,遂通过融合5种天然蛋白质的N端引导肽与血小板衍生生长因子受体(PDGFRβ)跨膜结构域,实现传感器在细胞膜外侧的靶向定位,提升筛选效率。最终通过饱和突变与细胞内灌注验证,获得两种核心变体:膜定位的RGEPO1(P299C突变体),在50 mM K⁺时ΔF/F达180%,EC₅₀为2.4±0.3 mM,检测范围为0.5-20 mM;胞质定位的RGEPO2(P152L/A298N突变体),200 mM K⁺时ΔF/F达334%,EC₅₀为43.3 mM。二者均具有完全可逆的荧光响应(洗去K⁺后恢复基线)。此外,研究团队还发现RGEPOs存在蓝光诱导的光激活现象(与jRGECO1a光激活特性类似),需在双色成像中注意通道采集顺序以避免干扰。综上,研究团队建立了“大肠杆菌初筛+哺乳动物细胞优化”的高效研发流程,成功获得两种RGEPOs(RGEPO1和RGEPO2),可满足0.5-200 mM宽浓度范围细胞内/外K⁺动态检测需求,为后续成像应用奠定基础。
图2. 传感器在HEK293FT细胞中的优化
图3. RGEPOs可逆性验证及RGEPO2在HEK293FT细胞胞质中表达的代表性图像
2、RGEPOs在溶液中的特性分析
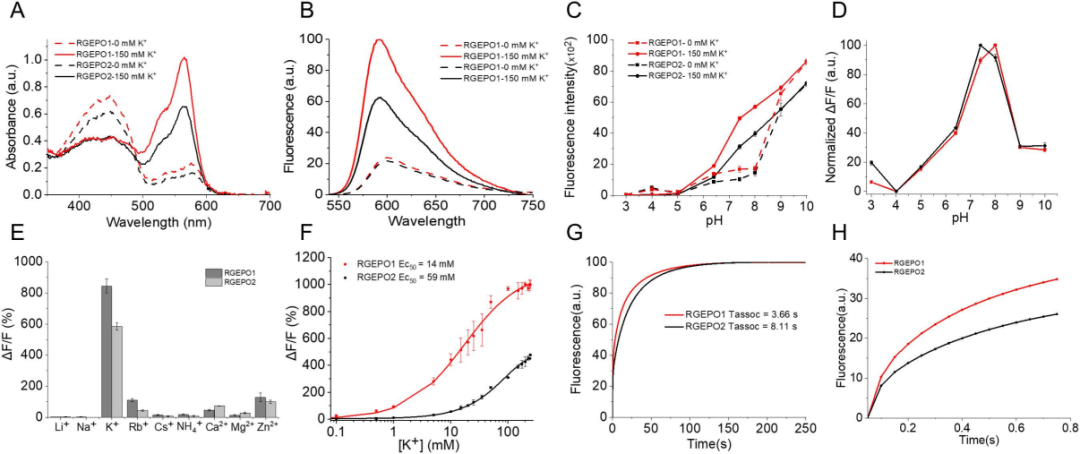
为明确RGEPOs在复杂哺乳动物系统中的适用性,研究团队在生理条件(0-150 mM K⁺、pH 7.4)下对其溶液特性展开分析。光谱特性上,RGEPO1与RGEPO2均呈现446-448 nm(发色团质子化)和576-578 nm(发色团去质子化)双吸收峰,添加150 mM K⁺后,576/578 nm处吸收峰增强、448/446 nm处吸收峰减弱,表明K⁺结合可诱导发色团去质子化;RGEPOs激发峰为574-575 nm,发射峰为591-593 nm,K⁺结合使其激发峰略蓝移至563 nm,150 mM K⁺可分别使二者荧光强度增加4.7倍(RGEPO1)和3.1倍(RGEPO2)。双光子特性显示,二者最佳激发波长为1040 nm(RGEPO1)和1120 nm(RGEPO2),适配在体成像需求。
pH敏感性与离子选择性方面,二者在pH 6.5-9.0均有响应,RGEPO1在pH 8.0、RGEPO2在生理pH 7.4时动态范围最大,K⁺结合后pKa值(酸解离常数的负对数)由8.55分别降至7.36(RGEPO1)与7.82(RGEPO2),表明其荧光对生理pH变化敏感;离子滴定中,仅Rb⁺(铷离子)、Ca²⁺(钙离子)、Zn²⁺(锌离子)有一定干扰,但生理浓度下K⁺诱导的ΔF/F最高(584%-844%),显著高于其他离子。且Ca²⁺在生理浓度下不会引起RGEPOs响应,进一步验证了RGEPOs对K⁺的特异性。
结合动力学与荧光寿命上,150 mM K⁺条件下,二者达50%荧光变化需3.66 s(RGEPO1)和8.11 s(RGEPO2);无K⁺时RGEPO1与RGEPO2的平均寿命分别为1.77 ns、1.75 ns,K⁺结合后分别降至1.71 ns、1.72 ns。综上,RGEPOs在溶液中表现出高特异性、高敏感性与良好的光谱特性,使其能够用于监测不同生理环境中的K⁺动态变化。
图4. RGEPOs的体外表征
3、K⁺敏感性的分子机制
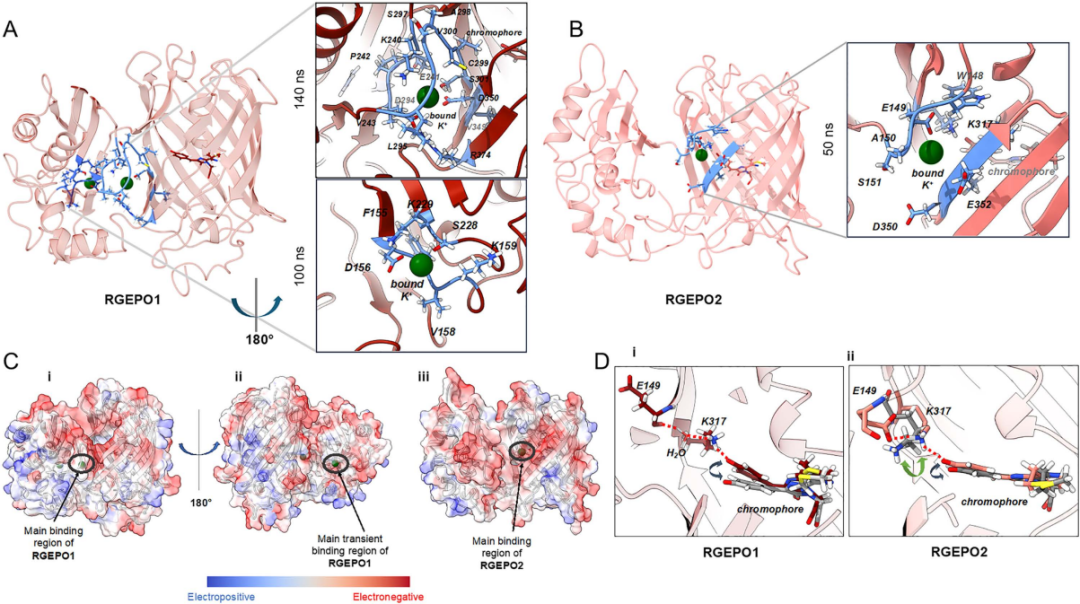
为揭示RGEPO1与RGEPO2对K⁺响应差异的分子机制,研究团队通过分子动力学(MD)模拟,在低(20 mM)、高(300 mM)K⁺及高Ca²⁺(300 mM)条件下分析了其结构与离子结合模式。结构差异上,二者连接肽区域存在关键不同:RGEPO2的N298与P299残基形成“开放构象”,导致β链结构消失,使发色团酚盐端更易接触溶剂,需更大构象变化才能产生荧光响应,从而解释了二者亮度差异。
K⁺结合口袋方面,RGEPO1存在两个口袋:主要口袋由13个氨基酸组成,D294、D350直接配位K⁺,结合稳定(约140 ns);瞬时口袋仅在低K⁺时出现,结合时间约100 ns。RGEPO2仅一个口袋,位置与RGEPO1的主要结合口袋相近但组成不同,K⁺结合时间约50 ns(短于RGEPO1),这与实验中观察到的RGEPO2亲和力略低(HEK293FT细胞中EC₅₀为43.3 mM vs RGEPO1的2.4 mM)一致。
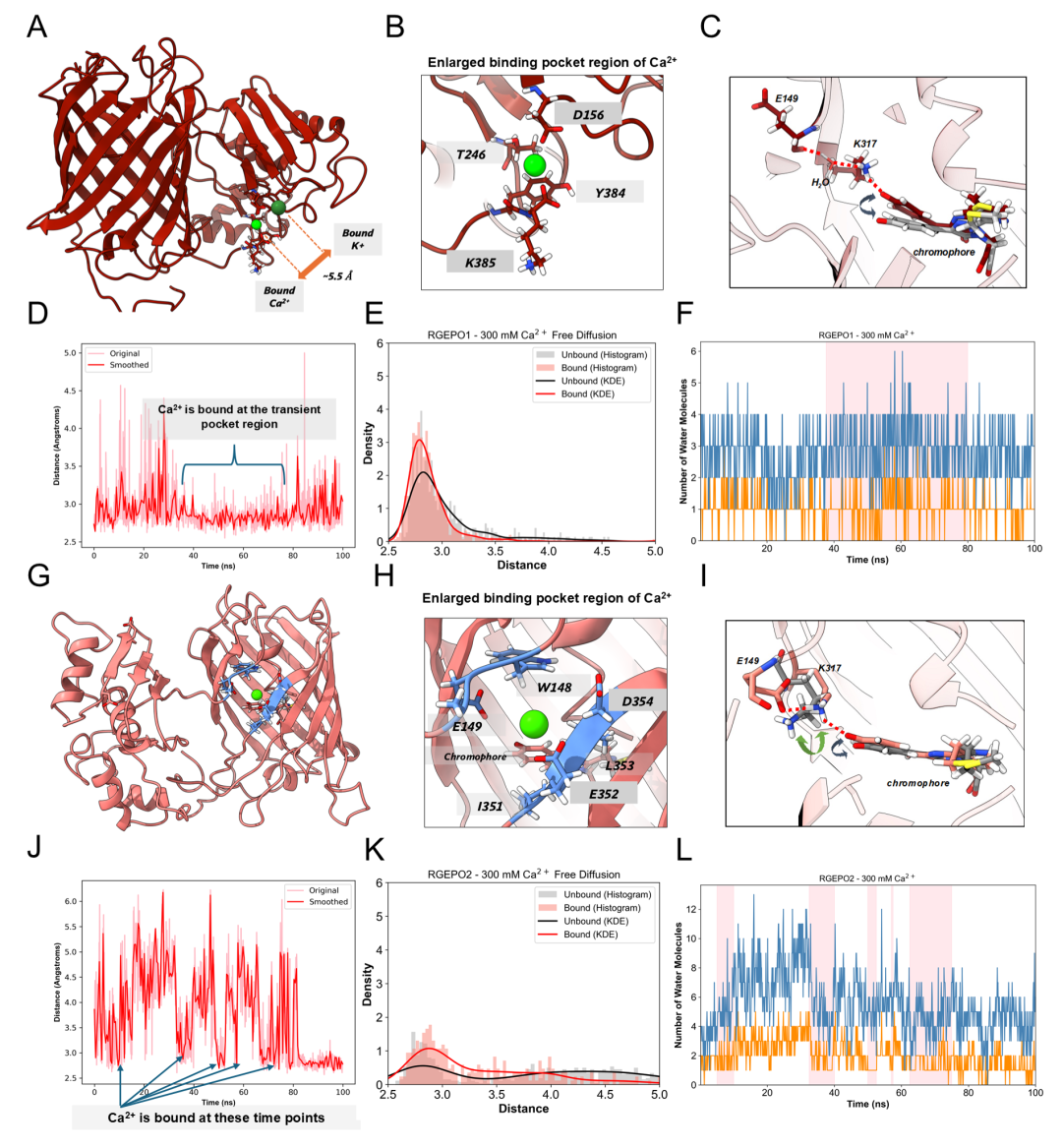
离子选择性上,高Ca²⁺模拟显示,Ca²⁺虽能在发色团附近瞬时出现,但结合稳定性远低于K⁺,无法触发荧光响应所需的构象变化,进一步证实RGEPOs对K⁺的选择性。另外,表面电荷分析显示,RGEPO1存在从主要口袋延伸至瞬时口袋的连续电负性区域,更易保留K⁺;RGEPO2仅主要口袋周围有负电聚集。这些结果表明RGEPO1作为荧光传感器的性能优于RGEPO2。此外,与已知的Ec-Kbp结合位点对比,二者静电分布差异显著,表明突变改造改变了结合区域,且mApple的电负性有助于稳定口袋。综上,MD模拟证实RGEPOs的主要结合口袋是其荧光响应关键。
图5. K⁺敏感性的分子机制
图6. Ca²⁺结合位点的MD模拟
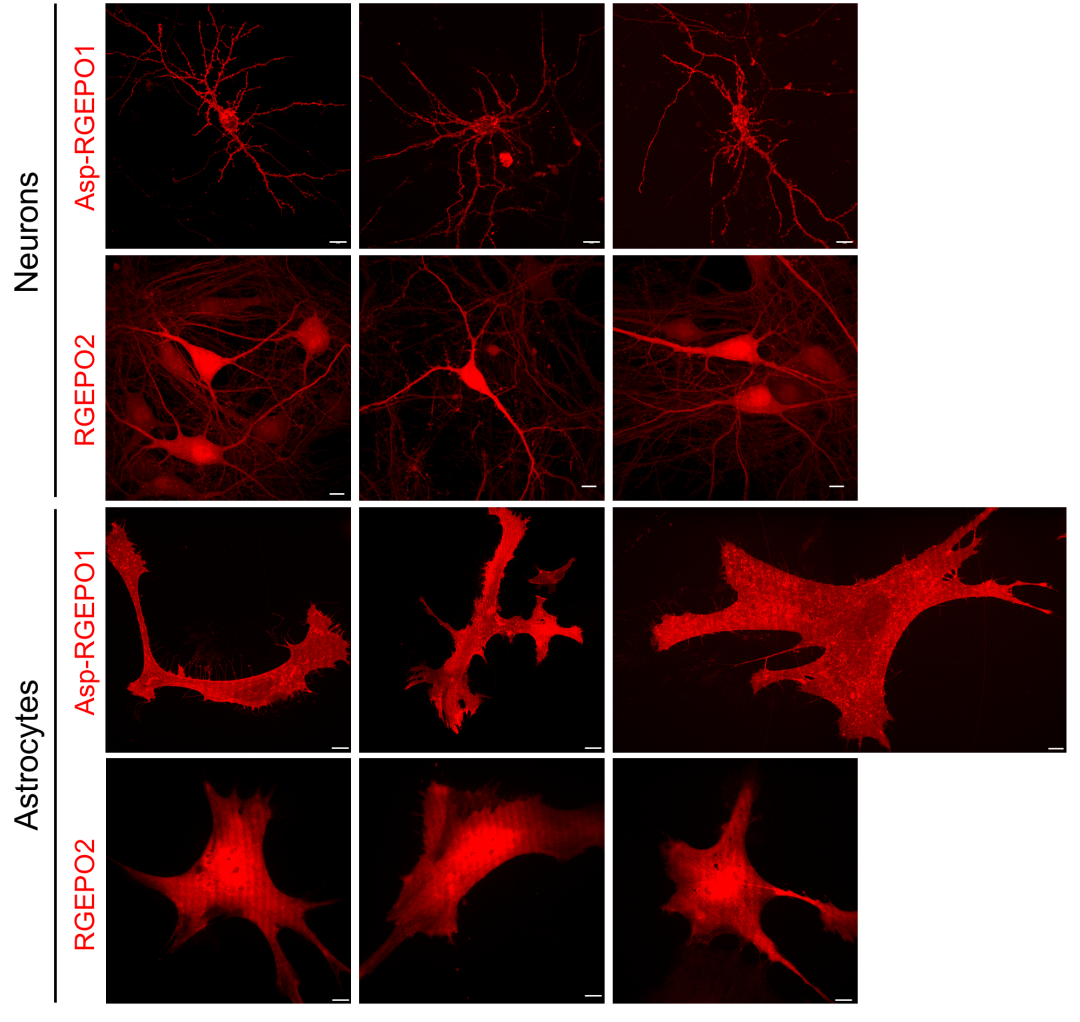
4、原代星形胶质细胞和神经元培养物中K⁺瞬变记录
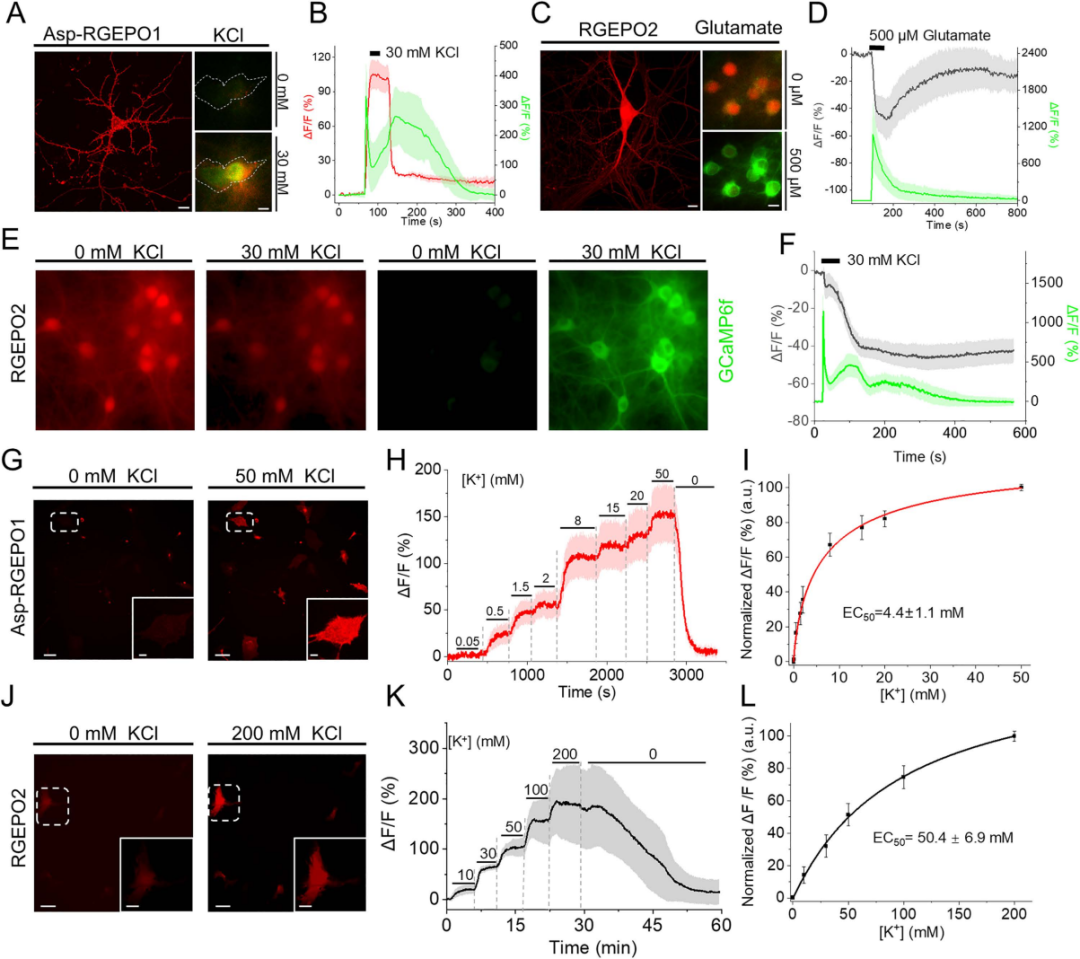
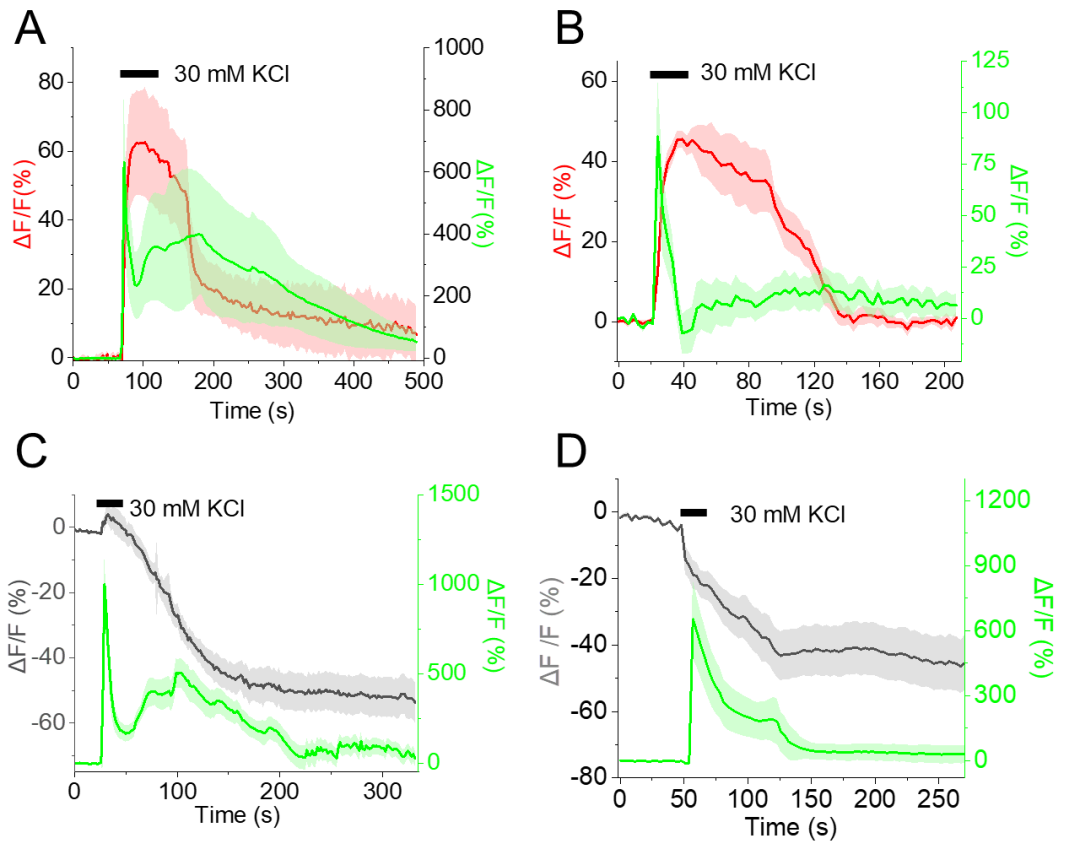
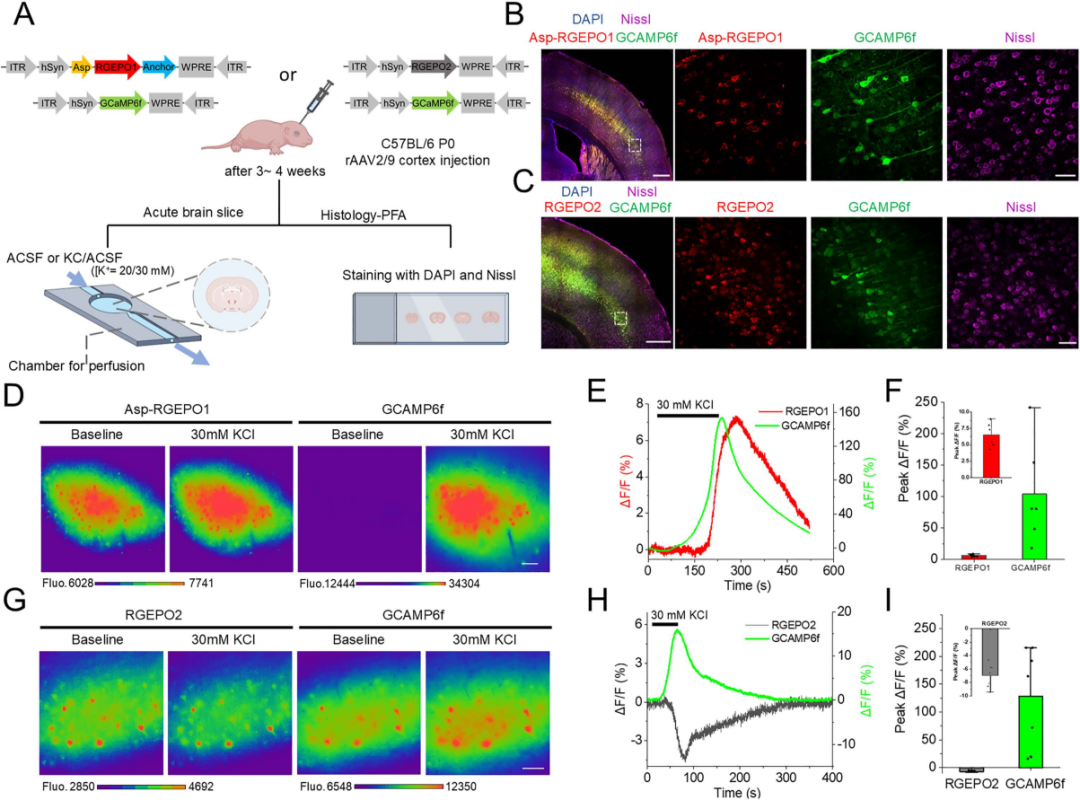
为验证RGEPOs在功能细胞中的应用,研究团队在原代海马神经元与皮层星形胶质细胞中检测了其对生理条件下K⁺动态变化的响应能力。在原代海马神经元中共表达RGEPO1与GCaMP6f,结果显示膜外侧靶向的RGEPO1在30 mM K⁺(诱导神经元去极化、提升兴奋性)刺激下荧光增强约71%(达到峰值时间约为27 s),胞质中Ca²⁺指示剂GCaMP6f的荧光增强约350%(达到峰值时间约为3 s),洗去K⁺后二者荧光均恢复至基线——这一结果表明RGEPO1可实时监测细胞外K⁺的升高,且与神经元活动(Ca²⁺内流)同步。
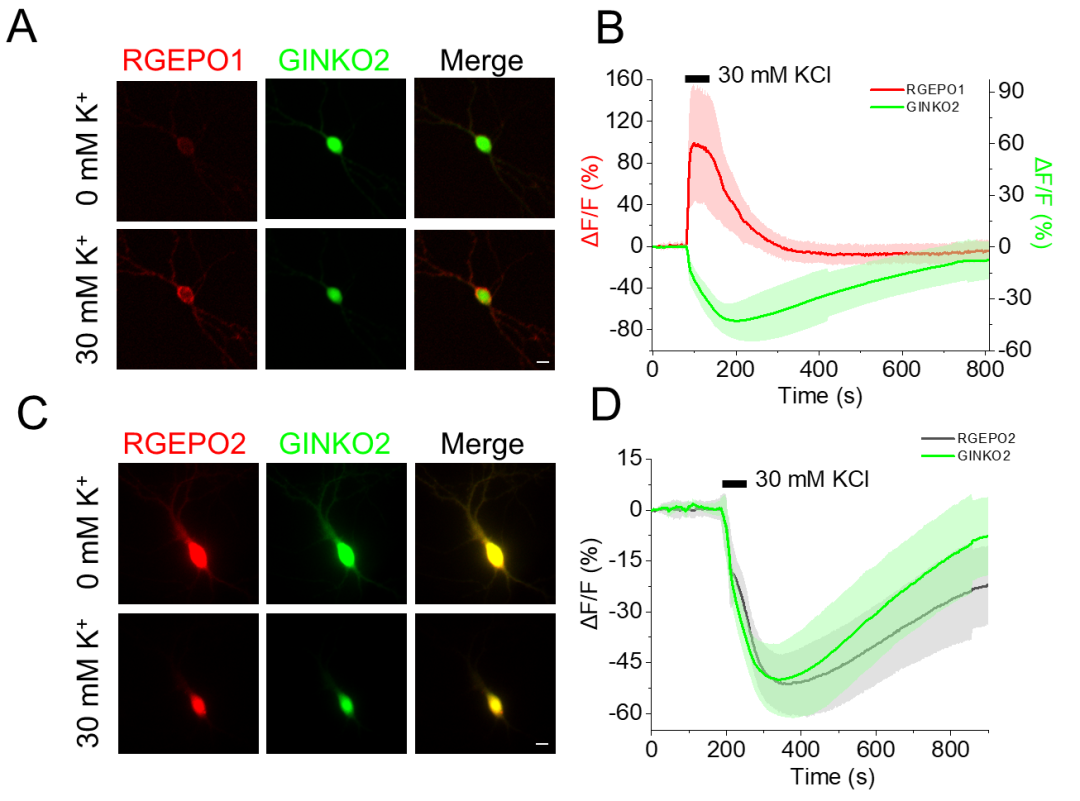
随后,在原代海马神经元中共表达RGEPO2与GCaMP6f,结果显示胞质表达的RGEPO2在500 μM谷氨酸(激活谷氨酸受体,诱导神经元兴奋与K⁺外流)刺激下,荧光降低约48%(峰值时间为72 s),GCaMP6f荧光增强约1076%(峰值时间为9 s),证实其能检测到细胞内K⁺的减少。接下来,为实现K⁺与Ca²⁺的同步成像,研究团队在培养的海马神经元中共表达RGEPO2与GCaMP6f。30 mM KCl短暂刺激后,神经元去极化诱导Ca²⁺内流,GCaMP6f绿色荧光增强约930%;同时,细胞内K⁺外流导致RGEPO2红色荧光降低约49%。表明RGEPO2可与Ca²⁺指示剂兼容,实现对神经元兴奋过程中两种关键离子动态的同步监测。此外,团队将其与成熟的绿色K⁺指示剂GINKO2(胞内定位)进行对比,结果显示RGEPOs的响应幅度和特异性与GINKO2相当,且可通过双色成像实现细胞内/外K⁺的同步监测。
图7. 原代神经元与星形胶质细胞培养物中K⁺瞬变的记录
图8. 表达Asp-RGEPO1和RGEPO2的活小鼠海马神经元及星形胶质细胞代表性图像
图9. 神经元中RGEPOs与GCaMP6f的荧光强度变化时间曲线
图10. RGEPOs与GINKO2各自的荧光强度变化时间曲线
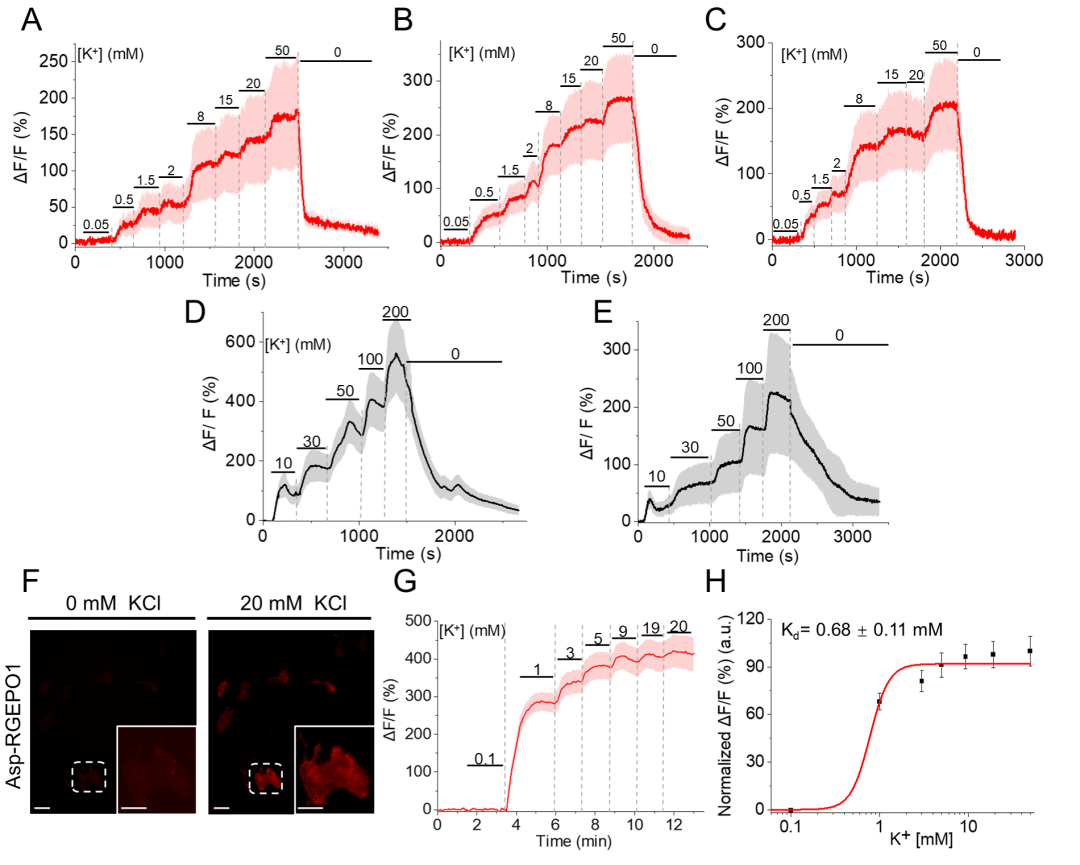
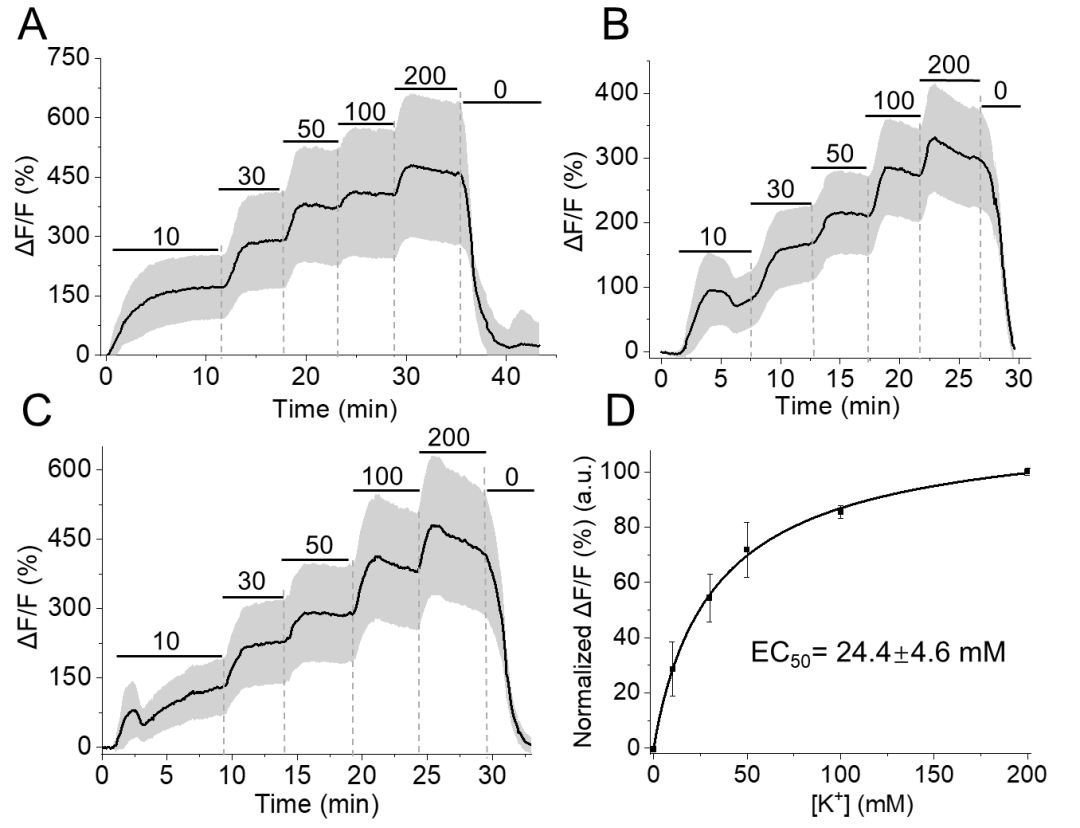
为评估RGEPOs的功能,团队在原代小鼠星形胶质细胞中瞬时表达这些传感器,结果显示,RGEPO1荧光增强随K⁺浓度升高而增加,50 mM K⁺时ΔF/F达206%,EC₅₀为4.4±1.1 mM;RGEPO2荧光变化同样具有K⁺浓度依赖性,在200 mM K⁺时ΔF/F达328%,EC₅₀约50±6.9 mM,与先前使用K⁺荧光染料获得的研究结果一致。此外,研究团队还探究了离子载体对星形胶质细胞K⁺摄取的影响:在缬氨霉素(促进K⁺内流)与羰基氰化物间氯苯腙(CCCP,维持pH稳定)存在的条件下,RGEPO2响应提升至430%(EC₅₀降至24 mM),且星形胶质细胞中响应强度是HEK293FT细胞的3倍,表明其K⁺调节能力更强。这些结果表明,细胞外K⁺浓度升高会触发星形胶质细胞摄取K⁺,证实了星形胶质细胞在K⁺空间缓冲中的关键作用。综上,RGEPOs可在功能细胞中有效监测K⁺动态,且适配多离子同步成像,性能与成熟指示剂相当。
图11. 星形胶质细胞外表面表达RGEPO1的膜定位验证
图12. 星形胶质细胞中RGEPOs的荧光强度变化时间曲线
图13. 在缬氨霉素和CCCP存在条件下,用一系列KCl缓冲液滴定RGEPO2时,其荧光强度变化的时间曲线
5、急性脑切片中神经元K⁺瞬变的记录
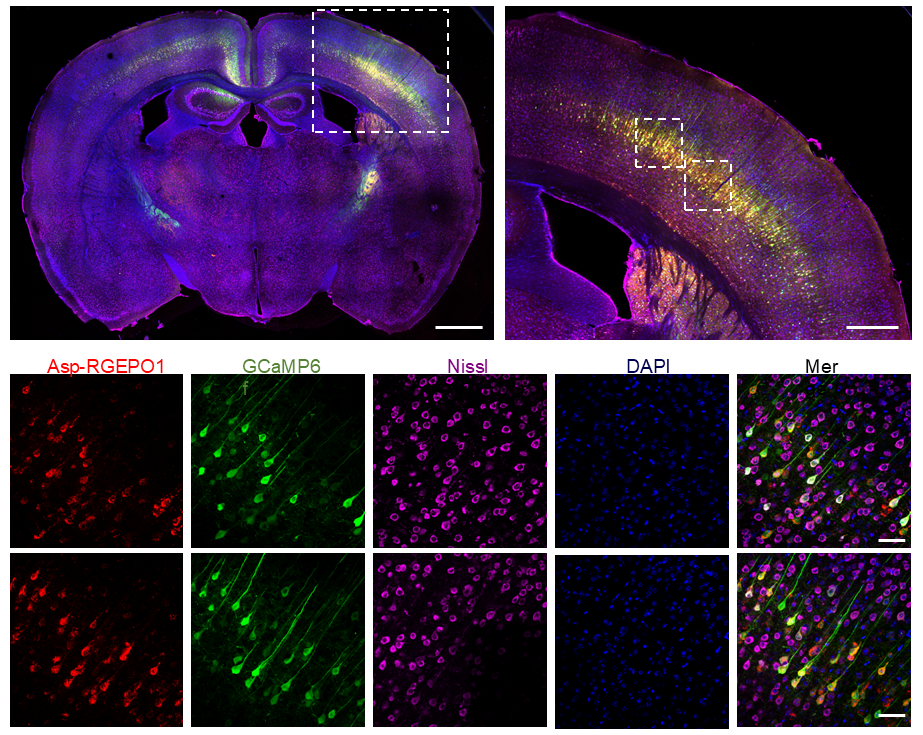
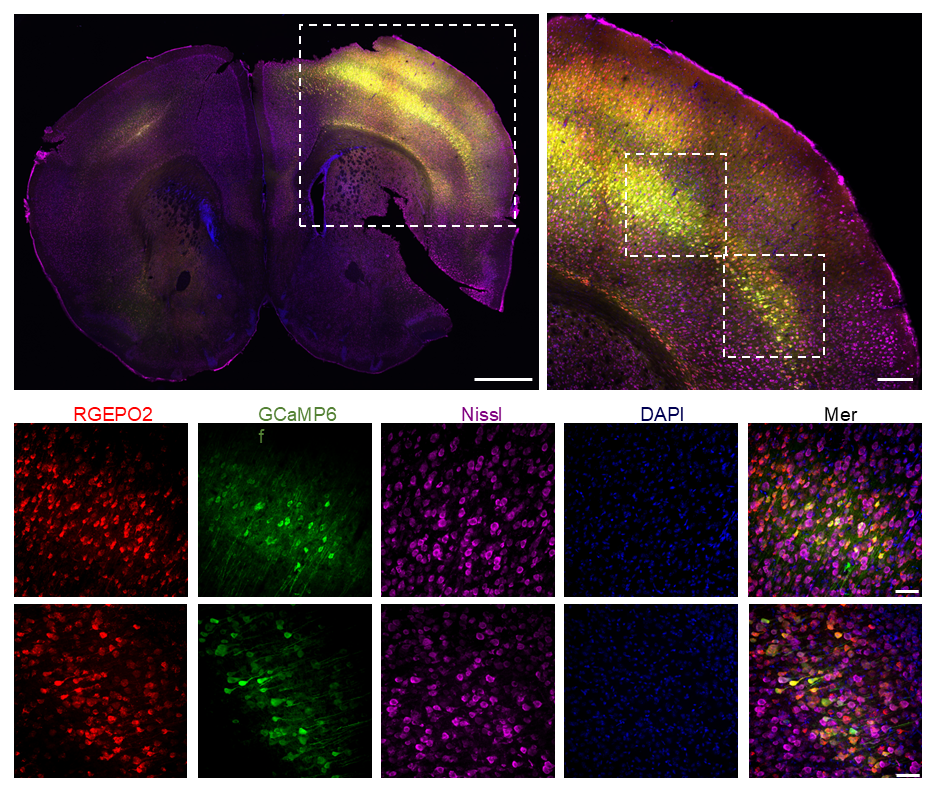
为验证RGEPOs在完整组织中的功能,研究团队将其应用于小鼠大脑皮层急性脑切片——该模型更接近体内生理环境,可评估组织复杂性对传感器性能的影响。研究团队利用由人突触蛋白1(hSyn)启动子驱动的重组腺相关病毒(rAAV2/9),在出生后第0天(P0)小鼠的皮层神经元中共表达RGEPO1或RGEPO2与GCaMP6f。3-4周后,制备350 μm厚的皮层急性脑切片,对其进行细胞外K⁺刺激后的荧光响应成像。首先通过荧光信号确认传感器表达:在脑切片的皮层区域可观察到清晰的红色(RGEPOs)与绿色(GCaMP6f)荧光,表明两种传感器均成功在神经元中表达且定位正确。随后,用20/30 mM KCl(模拟病理状态下的细胞外K⁺升高)对脑切片进行刺激:对于表达RGEPO1的脑切片,KCl刺激后RGEPO1的荧光增强6.5%,GCaMP6f的荧光增强104%,且二者响应具有可重复性,洗去KCl后均恢复至基线;对于表达RGEPO2的脑切片,KCl刺激后RGEPO2的荧光降低7.0%,GCaMP6f的荧光增强128%——这些趋势与培养神经元中观察到的一致,但ΔF/F值显著低于培养细胞。这种差异可能是由于蛋白质表达水平的不同,以及完整组织中存在更复杂的调控网络所致。尽管响应幅度降低,RGEPOs仍能在急性脑切片中清晰检测到K⁺的动态变化,且与神经元活动(GCaMP6f信号)严格同步,表明其可用于研究完整脑组织中细胞外和细胞内环境的K⁺动态变化,为后续在体研究奠定基础。
图14. RGEPOs在急性脑切片神经元中的成像
图15. RGEPO1与GCaMP6f共表达的大脑皮层图像
图16. RGEPO2与GCaMP6f共表达的大脑皮层图像
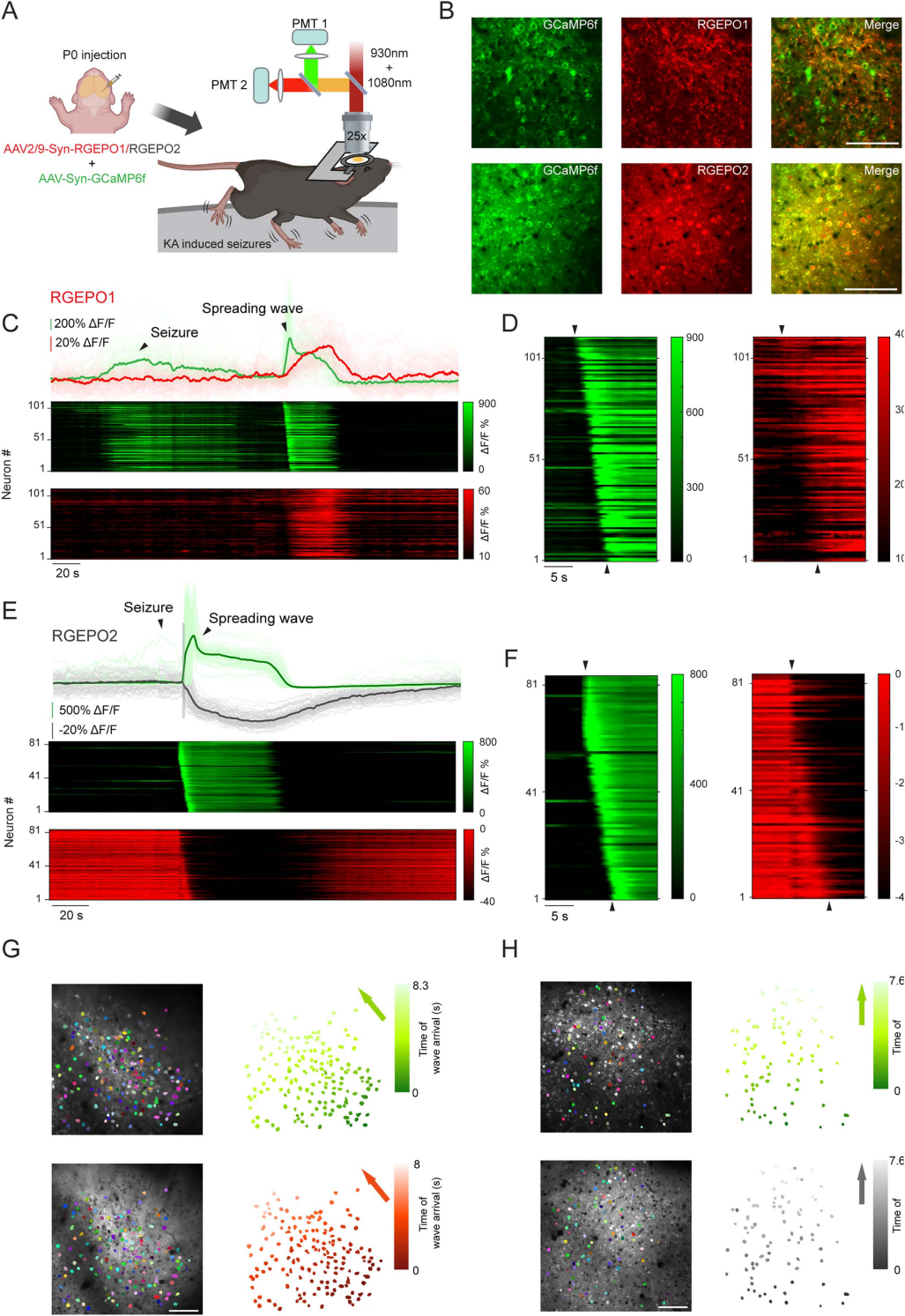
6、癫痫发作期间Ca²⁺与K⁺动态的双色新皮层成像
癫痫发作的核心病理特征是K⁺通道缺陷与K⁺稳态失衡,导致大脑过度兴奋,但此前缺乏能在体监测神经元群体K⁺动态的工具。于是研究团队接下来探究了利用RGEPOs在小鼠体内监测神经元群体K⁺动态变化的潜力。实验设计中,团队在小鼠初级躯体感觉皮层(属于新皮层)神经元中,通过AAV共表达GCaMP6f与RGEPO1或RGEPO2;7-8周后植入颅窗,待小鼠恢复后,通过腹腔注射海人酸(KA,20 mg/kg)诱导其癫痫发作,利用双光子显微镜捕捉L2/3层神经元荧光信号。结果显示,对于表达RGEPO1的小鼠,癫痫发作期间观察到两个关键现象:一是GCaMP6f信号呈现“同步荧光波”(对应癫痫发作起始,神经元群体同步兴奋),随后出现“扩散波”(对应皮层扩散性去极化,神经元群体依次去极化);二是RGEPO1信号在癫痫发作终止后出现扩散波,中位峰值ΔF/F为89%——该扩散波的空间分布与GCaMP6f的扩散波一致,但波前更宽(源于RGEPO1的响应动力学慢于GCaMP6f)。这些结果表明,RGEPO1能够在体可靠监测癫痫发作相关的胞外K⁺动态变化,同时证实其可与响应迅速的Ca²⁺指示剂兼容,适用于双色成像研究。
对于表达RGEPO2的小鼠,癫痫发作期间的响应呈现不同特征:RGEPO2的荧光在GCaMP6f癫痫发作起始波出现时快速降低,中位峰值ΔF/F为-52%,随后其扩散波与GCaMP6f的扩散波同步出现——这表明癫痫发作起始时,神经元兴奋导致细胞内K⁺快速外流(胞内K⁺降低),且这种K⁺降低随皮层扩散性去极化传播。值得注意的是,与急性脑切片相比,在体模型中RGEPOs的响应幅度更大。综上,团队首次在体内证实RGEPOs可监测病理状态下胞内/外的K⁺动态,且与Ca²⁺指示剂兼容,能以单细胞分辨率在群体水平上观察K⁺动态变化,为癫痫等K⁺失衡相关疾病的机制研究提供了全新工具。
图17. KA诱导癫痫发作小鼠中GCaMP6f与RGEPOs的双光子成像
总结
综上,研究团队将一种新型K⁺结合结构域Hv-Kbp插入到红色FP mApple中,成功开发出RGEPOs——RGEPO1和RGEPO2。与绿色GEPOs相比,RGEPOs具有多种优势,包括多色成像的兼容性、低光毒性,以及可应用于完整组织环境等。此外,在培养的神经元、星形胶质细胞、急性脑切片以及清醒小鼠体内,RGEPOs均能对细胞内和细胞外K⁺的变化产生灵敏响应。这些结果共同表明,RGEPOs是检测神经元活动过程中细胞内和细胞外K⁺变化的有效工具。
同时,研究团队也客观指出了RGEPOs的局限性:一是细胞内环境(尤其是完整脑组织)中的动态响应范围仍低于绿色GEPOs,这与胞内高本底K⁺浓度相关;二是存在蓝光诱导的光激活现象(基于mApple的红色K⁺生物传感器的典型特征),限制了与蓝光驱动光遗传学工具的联合应用;三是高表达时易形成斑点状聚集,可能影响信号准确性。未来研究将针对这些局限,通过突变改造优化结合亲和力与响应动力学、降低非特异性光激活效应,并进一步拓展其在其他疾病模型中的应用,最终助力人们更深入地理解K⁺在细胞生理功能中的作用。
西湖大学生命科学学院2020级博士研究生杨丽娜为第一作者,西湖大学生命科学学院/西湖实验室Kiryl D. Piatkevich助理教授与韦恩州立大学Alice R. Walker助理教授为论文共同通讯作者。本研究得到了国家自然科学基金以及浙江省“尖兵”“领雁”研发专项(2024SSYS0031,授予K.D.P.)的支持。
通讯作者介绍
Kiryl D. Piatkevich / 助理教授
学历/职称:莫斯科国立大学-纽约阿尔伯特爱因斯坦医学院联合培养化学博士,麻省理工学院博士后;现任西湖大学生命科学学院助理教授(2019年起独立领导分子生物工程实验室)。
研究方向:1)研发和设计尖端分子和成像技术,用于分析、控制和修复复杂生物系统,如大脑;2)设计用于光学记录和操控神经元活动的遗传编码分子工具,以及用于神经元解剖学追踪的荧光探针;3)阐明脑紊乱的分子机制与神经编码的基本原理;4)脑机接口构建。
关键成果:最早在蠕虫/鱼/小鼠中高精度记录神经元电压活动;多篇论文发于《Nature》《Nature Methods》等顶刊,部分为共同一作/通讯作者,涉小鼠神经成像、近红外钙离子指示剂研发。
我司可提供RGEPOs病毒产品,列表如下:


详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK