2025-11-10 阅读量:310
临床观察和流行病学研究均表明,负面情绪会加速癌症进展,而社交互动(SI)可能减缓癌症进展并改善患者预后。从进化角度来看,社交行为在哺乳动物的生存和适应性内稳态中发挥着进化上保守的作用。已有研究表明,SI与癌症进展速率降低及生存指标改善均相关;同时,癌症引发的焦虑可能通过神经通路加速癌症进展。值得注意的是,多项乳腺癌研究显示,SI与焦虑评分降低及生存期延长均相关。然而,迄今为止,这一关联的科学验证仍较少,且SI缓解癌症进展的机制仍不明确。
前扣带回皮层(ACC)是内侧前额叶皮层(mPFC)的一个亚区,在情绪反应和社交行为中尤为关键。ACC的谷氨酸能(ACCGlu)神经元广泛投射至基底外侧杏仁核(BLA),而BLA与焦虑及SI相关。既往研究表明,SI通过mPFC和杏仁核缓解负面情绪。因此,SI激活的ACC神经元可能整合社交信息,调节癌症引发的焦虑,进而影响癌症进展。
杏仁核包含形态和功能各异的亚核团,它们之间存在复杂的相互连接,主要包括BLA、中央外侧杏仁核(CeL)和中央内侧杏仁核(CeM)。杏仁核微环路在情绪、动机和SI中起关键作用。解剖学分析显示,BLA神经元以谷氨酸能(BLAGlu)为主,而CeL神经元为γ-氨基丁酸能(CeLGABA)。激活CeL中的BLAGlu末梢可兴奋CeLGABA神经元,后者进而对CeM神经元产生前馈抑制,以抑制其活性。CeM含有促肾上腺皮质激素释放激素(CRH)神经元,是杏仁核的主要输出核团。需要强调的是,作者前期研究证实,CeMCRH神经元在调节乳腺癌进展中起重要作用:人工抑制CeMCRH神经元可显著减轻焦虑并减缓肿瘤进展,而激活CeMCRH神经元则会显著加剧焦虑并加速肿瘤进展。鉴于BLAGlu神经元接收来自ACCGlu神经元的兴奋性输入,作者推测,SI通过动态调控ACCGlu-BLAGlu-CeLGABA-CeMCRH神经回路抑制肿瘤进展。
近期,陆军军医大学研究团队在Neuron杂志发表题为“Social interaction in mice suppresses breast cancer progression via a corticoamygdala neural circuit”文章,揭示了SI抑制乳腺癌进展的神经环路机制。该研究中,作者发现SI通过ACCGlu→BLAGlu→CeLGABA→CeMCRH神经通路介导其抗肿瘤效应。SI通过该通路降低肿瘤内交感神经活性并减少去甲肾上腺素(NE)释放,从而增强抗肿瘤免疫,抑制肿瘤生长。化学遗传学抑制SI激活的ACCGlu神经元及ACCGlu→BLA回路,可消除SI的抗肿瘤效应;而人工激活上述神经元及回路,则可模拟SI的抗肿瘤效果。综上所述,SI通过激活上述皮质-杏仁核神经回路抑制癌症进展,该机制为社交支持在癌症治疗中的临床应用提供了潜在靶点和科学依据。
1.SI可减缓乳腺癌进展
焦虑是乳腺癌患者的常见症状,而焦虑反过来又会促进癌症进展。越来越多的临床证据表明,SI可缓解乳腺癌患者的焦虑症状,并抑制癌症进展。
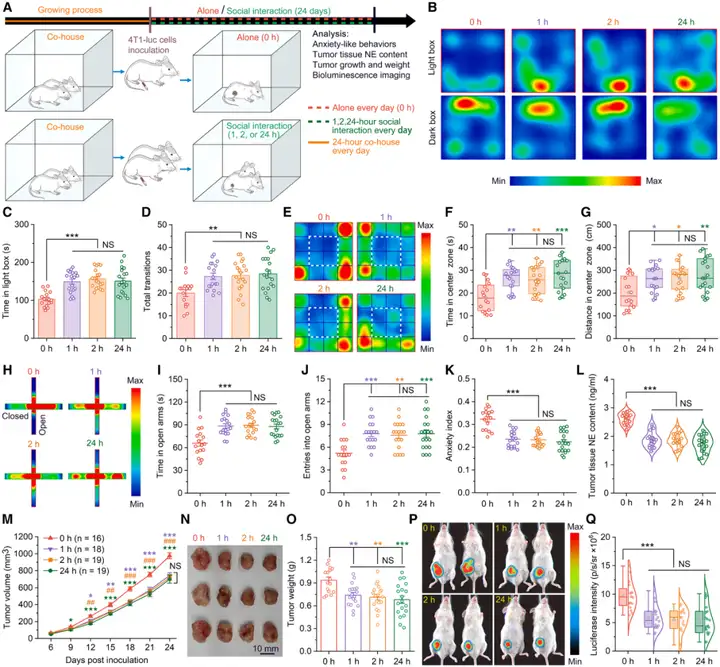
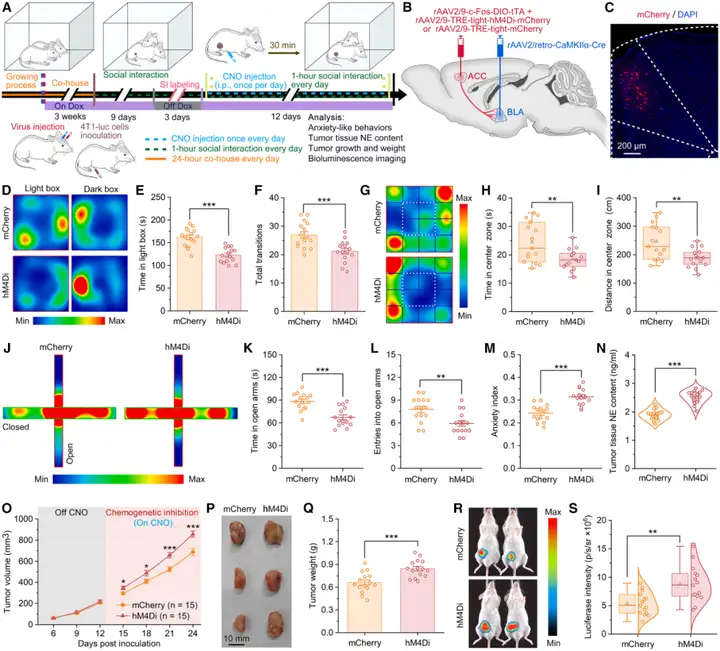
为探究SI与肿瘤进展之间的机制关联,研究人员评估了SI对小鼠焦虑样行为及乳腺癌进展的影响。在小鼠接种4T1-luc细胞[表达荧光素酶(Luciferase)报告基因的小鼠乳腺癌细胞]后,将其随机分为几组,分别给予每日1小时、2小时或24小时的SI[与无肿瘤(健康)雌性同笼饲养过的熟悉同窝小鼠共处],或使其连续24天单独饲养在笼内(无SI,0小时SI组)。结果显示,与0小时SI组相比,每日进行SI(无论时长)的荷瘤小鼠,其焦虑样行为显著减少。通过三种已验证的行为学实验评估焦虑样行为:明暗箱实验(LDT)、旷场实验(OFT)和高架十字迷宫实验(EPM)。
鉴于肿瘤内交感神经活性与焦虑水平及乳腺肿瘤进展呈正相关,研究者接下来通过检测肿瘤组织中NE浓度,评估了肿瘤内交感神经的活性。酶联免疫吸附测定(ELISA)数据显示,与单独饲养对照组(0小时SI)相比,三种SI方案(每日1小时、2小时或24小时互动)均能显著降低肿瘤内NE水平,这表明SI可抑制肿瘤内交感神经的过度激活。组织学分析显示,每日进行SI(1小时、2小时或24小时)的小鼠,其肿瘤组织中Ki67阳性增殖细胞比例显著降低,而TUNEL阳性凋亡细胞比例显著升高。此外,SI还能显著抑制4T1细胞原位肿瘤(细胞接种到乳腺脂肪垫)的生长、降低肿瘤重量并减弱生物发光(荧光素酶)强度。综上,这些结果表明,SI可通过抑制肿瘤内交感神经活性、缓解癌症诱导的焦虑,从而减缓乳腺癌进展。
图1.SI可缓解焦虑并抑制乳腺癌进展
2.ACCGlu神经元是SI发挥抗肿瘤效应的关键
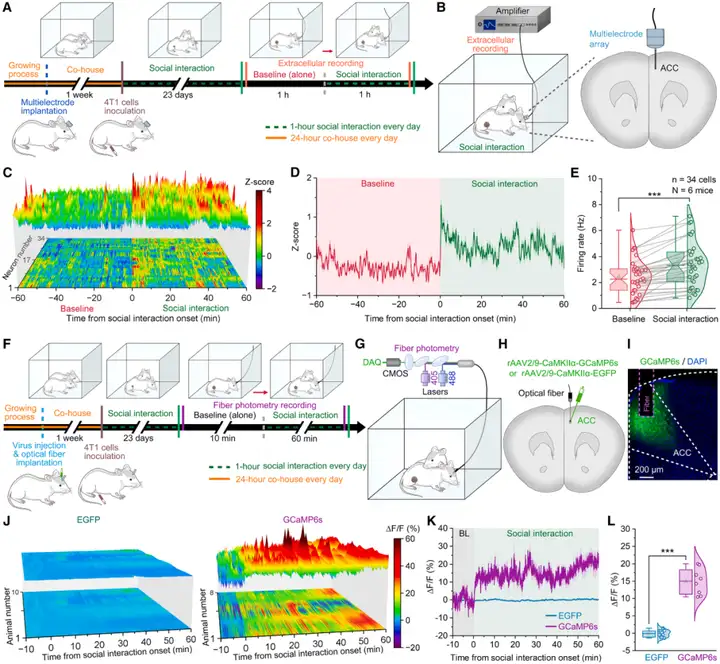
接下来,作者探究了SI抗肿瘤效应背后的神经机制。已知ACC位于dmPFC内,参与情绪反应与SI过程。为观察SI期间ACC神经元的神经活动动态,对自由活动的荷瘤小鼠进行ACC在体细胞外记录。结果显示,SI可显著提高ACC神经元的放电频率。此外,在1小时SI期间,社交接触开始时ACC神经元的放电频率进一步升高。考虑到在群体和单细胞水平上,谷氨酸能神经元都是ACC的主要输出神经元类型,随后重点研究了SI期间荷瘤小鼠的ACCGlu神经元活性。为明确ACCGlu神经元是否参与SI过程,首先检测了荷瘤小鼠ACC中c-Fos(一种反映神经活性的即时早期基因标志物)的表达。免疫荧光染色结果显示,与单独饲养对照组小鼠相比,SI组小鼠的ACCGlu神经元c-Fos表达水平显著更高。
为进一步实时观察SI期间荷瘤小鼠ACCGlu神经元的神经活动动态,在小鼠接种4T1细胞24天后进行了光纤光度法检测。将rAAV2/9-CaMKIIα-GCaMP6s病毒(表达基因编码钙指示剂GCaMP6s,报告神经元活动)或rAAV2/9-CaMKIIα-EGFP病毒(对照)注射到小鼠右侧ACC(rACC),随后在病毒注射部位上方植入一根光纤。结果同样显示,引入无肿瘤(健康)雌性同笼饲养过的熟悉同窝小鼠后,荷瘤小鼠的ACCGlu神经元活性显著升高,且SI期间该活性持续处于较高水平。在1小时SI期间,社交接触开始时ACCGlu神经元的活性进一步升高。综上,这些数据表明,SI可激活荷瘤小鼠的ACCGlu神经元。
此外,为明确ACCGlu神经元活性是否为SI发挥抗焦虑和抗肿瘤效应所必需,研究人员采用化学遗传学方法,在SI期间抑制荷瘤小鼠的ACCGlu神经元活性。向小鼠双侧ACC注射rAAV2/9-CaMKIIα-hM4Di-mCherry病毒或rAAV2/9-CaMKIIα-mCherry病毒。约3周后,将4T1-luc肿瘤细胞接种到病毒已表达的小鼠乳腺脂肪垫中。随后,荷瘤小鼠每天接受1小时SI,并在互动前腹腔注射hM4Di受体激动剂氯氮平-N-氧化物(CNO),连续处理24天。LDT、OFT和EPM的行为学结果显示,与表达mCherry的ACCGlu神经元组相比,SI期间对表达hM4Di的ACCGlu神经元进行化学遗传学抑制,可显著消除SI诱导的抗焦虑效应。相同的化学遗传学操作还显著提高了肿瘤内NE含量。此外,免疫荧光染色结果显示,对ACCGlu神经元进行化学遗传学抑制后,4T1肿瘤中Ki67阳性细胞比例显著升高,而TUNEL阳性细胞比例显著降低。SI期间抑制ACCGlu神经元活性,不仅显著加快了4T1肿瘤的生长速度,还显著增加了肿瘤重量和荧光素酶强度,这表明SI的抗肿瘤效应被逆转。这些结果表明,ACCGlu神经元活性是SI介导抗焦虑和抗肿瘤效应的关键。
图2.在荷瘤小鼠中,ACCGlu神经元对SI产生响应
3.ACCGlu神经元亚群介导SI的抗肿瘤效应
由于仅有一部分ACCGlu神经元会被SI激活,研究者随后采用活动依赖性的c-Fos Tet-Off系统标记对SI有反应(即SI标记)的ACCGlu神经元,并进一步结合化学遗传学、光遗传学探究该ACC神经元亚群在SI抗焦虑及抗肿瘤效应中的功能作用(标记和调控与特定事件相关的神经元亚群)。首先,研究人员将rAAV2/9-CaMKIIα-Cre病毒与rAAV2/9-c-Fos-DIO-tTA病毒,分别与rAAV2/9-TRE-tight-jGCaMP7s病毒(表达钙指示剂jGCaMP7s)或rAAV2/9-TRE-tight-EGFP病毒(作为对照)共同注射到小鼠rACC,并在病毒注射部位上方植入光纤。手术后,每只小鼠均与无肿瘤(健康)雌性熟悉同窝小鼠(同伴小鼠)同笼饲养,并喂食含多西环素(Dox)的饲料,以防止jGCaMP7s或EGFP的表达。术后2周,将4T1-luc肿瘤细胞接种到病毒已表达的小鼠乳腺脂肪垫中,并让荷瘤小鼠每天接受1小时SI,持续9天。随后,为用jGCaMP7s或EGFP标记SI激活的ACCGlu神经元,所有小鼠均撤用Dox,持续3天,期间荷瘤小鼠仍保持每天1小时SI。为记录SI期间SI标记的ACCGlu神经元活性,在小鼠接种4T1细胞24天后进行光纤光度法检测,结果发现,荷瘤小鼠中SI标记的ACCGlu神经元,在SI期间活性显著升高。
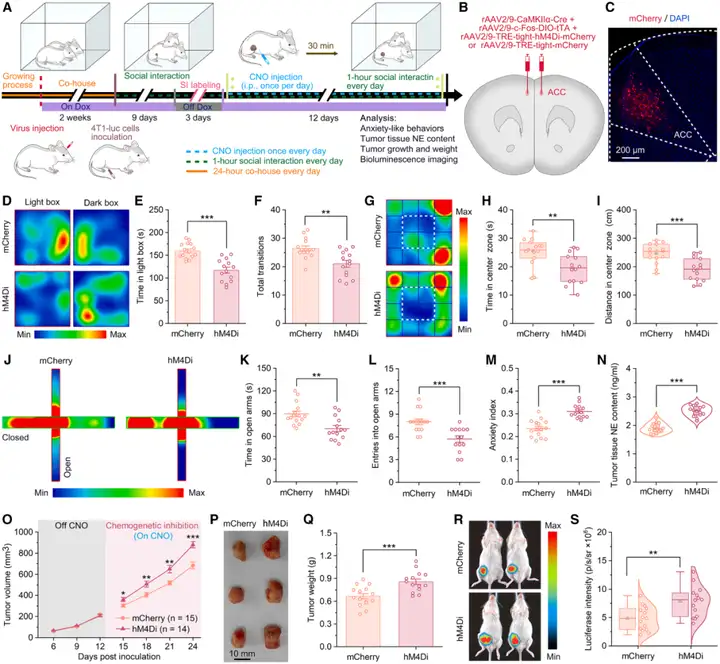
接下来探究:SI标记的ACCGlu神经元是否在SI诱导的抗焦虑及抗肿瘤效应中发挥关键作用?为解答这一问题,研究者采用化学遗传学方法,在SI期间抑制SI标记的ACCGlu神经元活性。将rAAV2/9-CaMKIIα-Cre病毒与rAAV2/9-c-Fos-DIO-tTA病毒,分别与rAAV2/9-TRE-tight-hM4Di-mCherry病毒或rAAV2/9-TRE-tight-mCherry病毒共同注射到小鼠双侧ACC。随后小鼠遵循相同实验流程,SI标记的ACCGlu神经元分别被hM4Di或mCherry标记。结果符合预期:在SI期间注射CNO以抑制SI标记的ACCGlu神经元活性后,SI诱导的抗焦虑效应被显著破坏,且肿瘤内NE含量升高。相同的化学遗传学操作还导致4T1肿瘤中Ki67阳性细胞比例显著升高,TUNEL阳性细胞比例显著降低。此外,持续的化学遗传学抑制还显著加快了4T1肿瘤的生长速度,增加了肿瘤重量和荧光素酶强度,这表明SI的抗肿瘤效应被逆转。
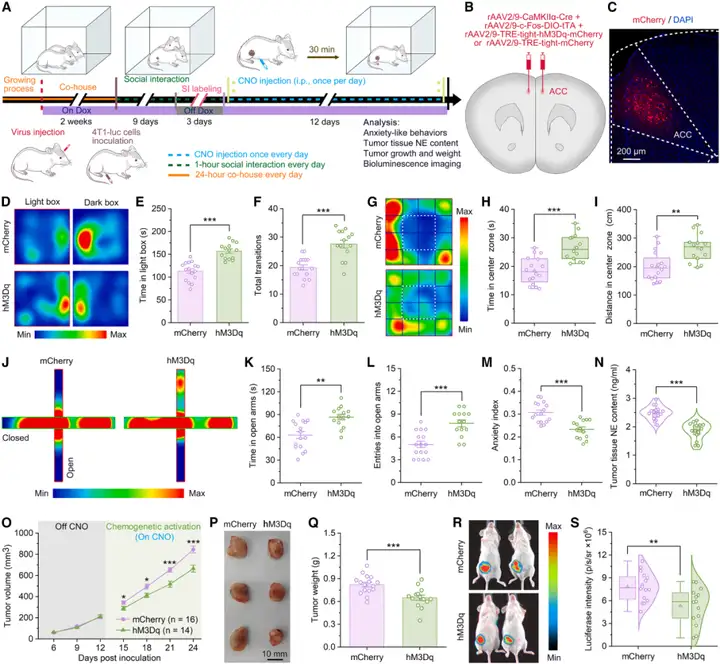
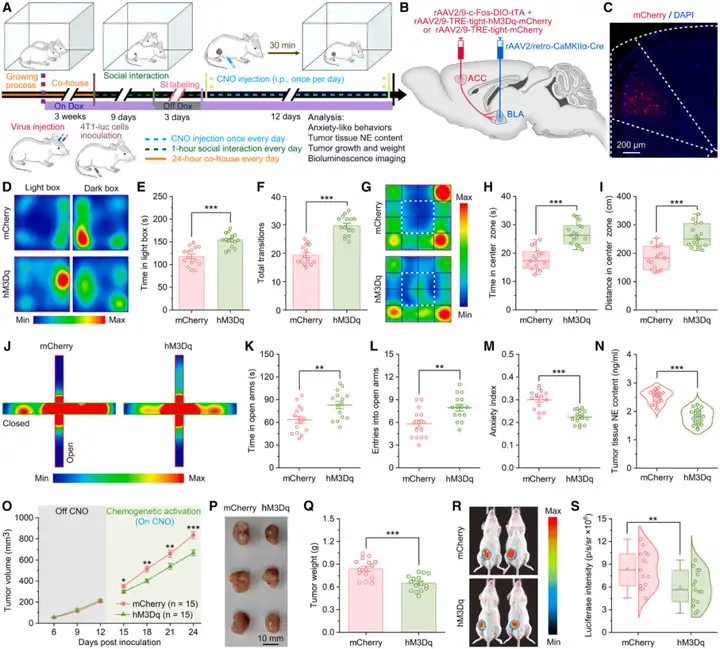
此外,作者还测试了:激活SI标记的ACCGlu神经元,是否足以模拟SI的抗焦虑及抗肿瘤效应?为激活SI标记的ACCGlu神经元,将rAAV2/9-CaMKIIα-Cre病毒与rAAV2/9-c-Fos-DIO-tTA病毒,分别与rAAV2/9-TRE-tight-hM3Dq-mCherry病毒或rAAV2/9-TRE-tight-mCherry病毒共同注射到小鼠双侧ACC。随后小鼠遵循相同实验流程,SI标记的ACCGlu神经元分别被hM3Dq或mCherry标记。完成SI标记后,通过每天注射一次CNO,持续12天,激活这些SI标记的ACCGlu神经元,以模拟SI。结果符合预期:12天的化学遗传学激活显著减少了4T1荷瘤小鼠的焦虑样行为,并降低了肿瘤内NE含量。此外,这种人工激活还显著降低了4T1肿瘤中Ki67阳性细胞比例,升高了TUNEL阳性细胞比例。持续的人工激活还降低了4T1肿瘤的生长速度、重量和荧光素酶强度。这表明,激活SI标记的ACCGlu神经元,足以模拟SI的抗焦虑及抗肿瘤效应。综上,这些结果表明:被SI激活的ACCGlu神经元,其活性对于介导SI的抗焦虑及抗肿瘤效应而言,既是必要条件,也是充分条件。
图3.化学遗传学抑制SI标记的ACCGlu神经元,可消除SI的抗焦虑及抗肿瘤效应
图4.化学遗传学激活SI标记的ACCGlu神经元,足以模拟SI的抗焦虑及抗肿瘤效应
4.连接SI与乳腺癌进展减缓的神经环路
ACCGlu神经元会向大量下游脑区投射轴突末梢,因此,介导SI抗焦虑及抗肿瘤效应的神经环路目前仍不明确。BLA处于高度连接的情绪与社交脑网络中,且接收来自ACC的大量输入信号。为进一步验证ACCGlu→BLA投射的存在,研究者将顺行病毒rAAV2/9-CaMKIIα-mCherry注射到小鼠rACC。组织学结果显示,来自rACCGlu神经元的mCherry阳性投射纤维在BLA中密集分布,这表明rACCGlu神经元会向BLA发送强烈的投射信号。接下来,为特异性观察荷瘤小鼠中SI标记的、向BLA投射的ACCGlu神经元对SI的反应,将表达Cre重组酶的逆行病毒(rAAV2/retro-CaMKIIα-Cre)注射到小鼠双侧BLA,并将rAAV2/9-c-Fos-DIO-tTA病毒与rAAV2/9-TRE-tight-jGCaMP7s病毒(或rAAV2/9-TRE-tight-EGFP病毒,作为对照)共同注射到小鼠双侧ACC。完成SI标记后,在小鼠接种4T1细胞24天后进行光纤光度法检测,结果发现,荷瘤小鼠中SI标记的、向BLA投射的ACCGlu神经元,在SI期间活性显著升高。
为验证被SI激活的ACCGlu→BLA投射是否参与SI的抗焦虑及抗肿瘤效应,将rAAV2/retro-CaMKIIα-Cre病毒注射到小鼠双侧BLA,并将rAAV2/9-c-Fos-DIO-tTA病毒与rAAV2/9-TRE-tight-hM4Di-mCherry病毒(或rAAV2/9-TRE-tight-mCherry病毒,作为对照)共同注射到小鼠双侧ACC。结果符合预期:在SI期间注射CNO,以抑制SI标记的、向BLA投射的ACCGlu神经元活性后,SI诱导的抗焦虑效应被显著阻断,且肿瘤内NE含量升高。对该类神经元的抑制还导致4T1肿瘤中Ki67阳性细胞比例显著升高、TUNEL阳性细胞比例显著降低;此外,化学遗传学抑制还显著加快了4T1肿瘤的生长速度、增加了肿瘤重量和荧光素酶强度,这表明SI的抗肿瘤效应被逆转。
随后,还测试了激活被SI激活的ACCGlu→BLA投射是否足以模拟SI的抗焦虑及抗肿瘤效应。为激活SI标记的、向BLA投射的ACCGlu神经元,将rAAV2/retro-CaMKIIα-Cre病毒注射到小鼠双侧BLA,并将rAAV2/9-c-Fos-DIO-tTA病毒与rAAV2/9-TRE-tight-hM3Dq-mCherry病毒(或rAAV2/9-TRE-tight-mCherry病毒,作为对照)共同注射到小鼠双侧ACC。完成SI标记后,通过每天注射一次CNO、持续12天,激活这些神经元以模拟SI。结果符合预期:12天的化学遗传学激活显著减少了4T1荷瘤小鼠的焦虑样行为,并降低了肿瘤内NE含量;此外,这种人工激活还显著降低了4T1肿瘤中Ki67阳性细胞比例、升高了TUNEL阳性细胞比例,同时降低了肿瘤生长速度、重量和荧光素酶强度,这表明激活被SI激活的ACCGlu→BLA投射,足以模拟SI的抗焦虑及抗肿瘤效应。
此外,在MMTV-PyMT小鼠模型中[通过小鼠乳腺肿瘤病毒(MMTV)启动子(MMTV-LTR)驱动乳腺组织特异性表达癌基因PyMT(编码多瘤病毒中T抗原)的转基因小鼠,自发形成乳腺癌],研究人员同样通过每天注射一次CNO、持续15天,激活向BLA投射的ACCGlu神经元以模拟SI。结果一致显示:15天的化学遗传学激活显著缓解了PyMT荷瘤小鼠的焦虑样行为,并降低了肿瘤内NE含量。此外,这种激活显著下调了PyMT肿瘤中Ki67阳性细胞比例,同时上调了TUNEL阳性细胞比例。更重要的是,持续化学遗传激活还降低了PyMT肿瘤的生长速度及重量。综上,这些结果表明,被SI激活的ACCGlu→BLA投射的活性,对于介导SI的抗焦虑及抗肿瘤效应而言,既是必要条件,也是充分条件。
杏仁核是一组核团的集合,主要包括BLA、CeL和CeM。杏仁核微环路在情绪、动机及SI中发挥关键作用。更重要的是,BLAGlu神经元的激活可激活CeLGABA神经元,进而通过前馈抑制作用调控CeM输出神经元。作者前期研究已表明,CeMCRH神经元在调控乳腺癌进展中起关键作用。已有研究证实BLAGlu神经元会接收来自ACCGlu神经元的兴奋性输入。因此,作者推测,被SI激活的ACCGlu→BLA投射可能通过以下机制发挥作用:激活BLAGlu神经元,进而增强CeLGABA神经元的活性,通过前馈抑制作用降低过度激活的CeMCRH神经元的活性。
为验证这一假设,研究人员通过在体光纤光度法,检测了表达GCaMP6s的对SI有响应的BLAGlu神经元、CeLGABA神经元及CeMCRH神经元的活性。结果显示:SI期间,BLAGlu神经元和CeLGABA神经元的钙信号显著升高,而CeMCRH神经元的钙信号显著降低;重要的是,在1小时SI期间,社交接触发生时,BLAGlu神经元和CeLGABA神经元的活性进一步升高,而CeMCRH神经元的活性进一步降低。
此外,为进一步阐明激活SI标记的ACCGlu神经元对上述三类神经元活性的影响,作者采用光遗传学方法特异性激活SI标记的ACCGlu神经元,并通过光纤光度法检测自由活动荷瘤小鼠中这些神经元的活性。研究人员将携带活动依赖性、Cre依赖性Tet-off系统的病毒(该病毒表达光通道视紫红质-2,即光敏蛋白ChR2)注射到ACC,同时将表达GCaMP6s(或EGFP/EYFP,作为对照)的病毒分别注射到BLA、CeL或CeM。光遗传学结合光纤光度法的记录结果显示:光遗传学激活SI标记的ACCGlu神经元,显著升高了BLAGlu神经元和CeLGABA神经元的钙信号,同时显著降低了CeMCRH神经元的钙信号。与这些结果一致的是,光遗传学激活SI标记的、向BLA投射的ACCGlu神经元,同样显著升高了BLAGlu神经元和CeLGABA神经元的钙信号,并如预期般降低了CeMCRH神经元的钙信号。综上,这些发现表明,被SI激活的ACCGlu→BLA投射可升高BLAGlu神经元和CeLGABA神经元的活性,进而通过增强CeLGABA神经元的前馈抑制作用,降低过度激活的CeMCRH神经元的活性。
图5.激活SI标记的、投射至BLA的ACCGlu神经元,足以模拟SI的抗焦虑及抗肿瘤效应
图6.化学遗传学抑制SI标记的、投射至BLA的ACCGlu神经元,会削弱SI的抗焦虑及抗肿瘤效应
5.SI可增强抗肿瘤免疫
为探究SI诱导的肿瘤内分子变化,通过每天注射一次CNO、持续12天,对SI标记的、向BLA投射的ACCGlu神经元进行化学遗传学激活,以模拟SI,随后对4T1荷瘤小鼠的肿瘤进行转录组分析。bulk RNA测序(RNA-seq)结果显示,hM3Dq组(激活组)与mCherry组(对照组)的基因表达模式存在显著差异;主成分分析(PCA)图显示两组样本完全分离。值得注意的是,mCherry组的转录异质性更高,而hM3Dq组的基因表达谱更均一,这表明神经调控策略可降低肿瘤异质性。差异表达分析显示,与mCherry组肿瘤相比,hM3Dq组肿瘤中共有763个显著差异表达基因(DEGs),其中69个基因上调,694个基因下调。对这些DEGs的功能富集分析显示,它们主要与免疫相关通路相关,包括炎症反应调控(GO数据库)以及Th1/Th2细胞分化和Th17细胞分化(KEGG数据库);后者还通过基因集富集分析(GSEA)得到进一步验证。此外,单细胞RNA-seq(scRNA-seq)结果表明,SI可重塑肿瘤免疫微环境,具体表现为CD4+T细胞和CD8+T细胞群体扩大,且巨噬细胞亚群分布改变。对这些T细胞的转录组谱分析显示,与淋巴细胞分化和T细胞激活相关的基因程序显著富集(GO数据库);KEGG分析则证实,Th1/Th2细胞分化、Th17细胞分化以及癌症中PD-L1表达与PD-1检查点通路也协同富集。综上,这些发现表明,SI可通过同时促进T细胞募集/分化、精细调控免疫检查点相互作用,从而增强抗肿瘤免疫。而被SI激活的ACCGlu→BLA投射的激活,之所以能缩小肿瘤体积,可能是因为它激活了肿瘤免疫微环境中的抗肿瘤通路。
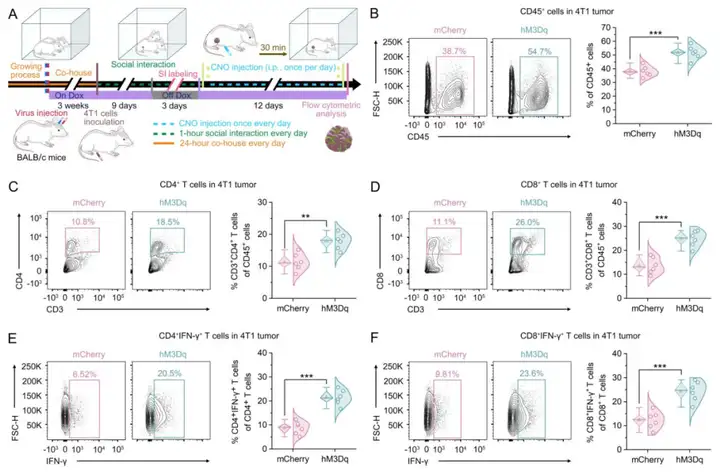
为从功能上验证转录组分析结果,作者采用流式细胞术,探究SI是否会改变肿瘤微环境中的免疫反应,重点关注肿瘤浸润淋巴细胞群体。对4T1荷瘤小鼠进行相同的病毒注射,以化学遗传学激活SI标记的、向BLA投射的ACCGlu神经元(模拟SI)或进行假激活(对照处理)。流式细胞术结果显示,对SI标记的、向BLA投射的ACCGlu神经元进行12天的激活后,4T1肿瘤中浸润的CD45+白细胞比例显著升高。对增多的浸润CD45+白细胞进行分型发现,模拟SI 12天后,CD4+T细胞和CD8+T细胞群体显著增加。已知CD11b+Gr-1+髓系来源抑制细胞(MDSCs)会抑制肿瘤微环境中的免疫反应,并直接刺激肿瘤发生,从而促进肿瘤发展。结果显示,与对照组小鼠相比,hM3Dq表达组小鼠的4T1肿瘤中,MDSCs比例显著降低。研究人员还观察到,hM3Dq表达组小鼠的4T1肿瘤中,CD4+CD25+FOXP3+调节性T细胞(Tregs)比例也显著降低。此外,模拟SI 12天显著降低了4T1肿瘤中CD4+PD-1+T细胞和CD8+PD-1+T细胞的比例,但显著升高了CD4+IFN-γ+T细胞和CD8+IFN-γ+T细胞的比例。同时,模拟SI 12天还显著升高了4T1肿瘤中CD11b+F4/80+CD86+CD206-M1型巨噬细胞的比例及M1/M2型巨噬细胞比值,但对CD11b+F4/80+CD86−CD206+M2型巨噬细胞的比例无显著影响。
研究者还评估了SI对PyMT肿瘤中免疫反应的影响。结果一致显示,流式细胞术分析表明,对SI标记的、向BLA投射的ACCGlu神经元进行15天的激活(模拟SI)后,PyMT肿瘤中浸润的CD45+白细胞、CD4+T细胞和CD8+T细胞均显著增加。模拟SI 15天显著降低了PyMT肿瘤中MDSCs、Tregs、CD4+PD-1+T细胞和CD8+PD-1+T细胞的比例,同时显著升高了CD4+IFN-γ+T细胞和CD8+IFN-γ+T细胞的比例。此外,模拟SI 15天还显著升高了PyMT肿瘤中CD11b+F4/80+CD86+CD206-M1型巨噬细胞的比例及M1/M2型巨噬细胞比值,但对CD11b+F4/80+CD86-CD206+M2型巨噬细胞的比例无显著影响。这些结果表明,SI可抑制肿瘤微环境中的免疫抑制作用,并促进抗肿瘤免疫。
图7.人工模拟SI可抑制肿瘤内的免疫抑制状态
图8.人工模拟SI可增强4T1荷瘤小鼠肿瘤中的抗肿瘤免疫应答
总结
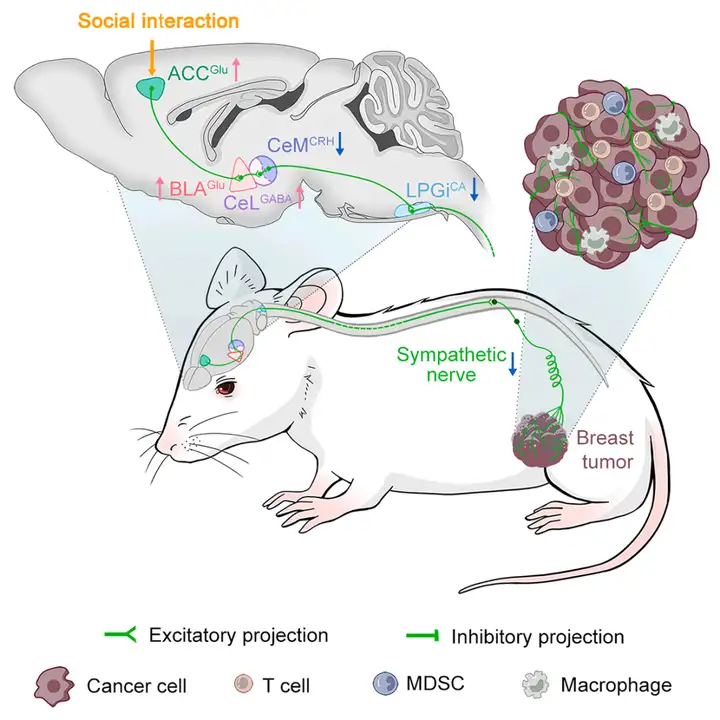
本研究发现ACCGlu→BLAGlu→CeLGABA→CeMCRH神经通路在介导SI的抗肿瘤效应中发挥独特作用。SI通过抑制过度激活的CeMCRH神经元,降低肿瘤内交感神经活性及NE释放,从而增强抗肿瘤免疫,延缓肿瘤进展。这些发现表明,上述皮质-杏仁核通路有望成为新型癌症治疗的潜在靶点,并揭示了SI通过神经机制发挥治疗效应的具体路径。
尽管本研究为SI的抗肿瘤效应奠定了神经通路基础,但具体的免疫介质及其细胞类型特异性仍需进一步研究。未来结合空间转录组学与免疫扰动技术的研究,对解析这一神经-免疫级联反应的完整机制至关重要。
SI抑制乳腺癌进展的神经通路机制模式图
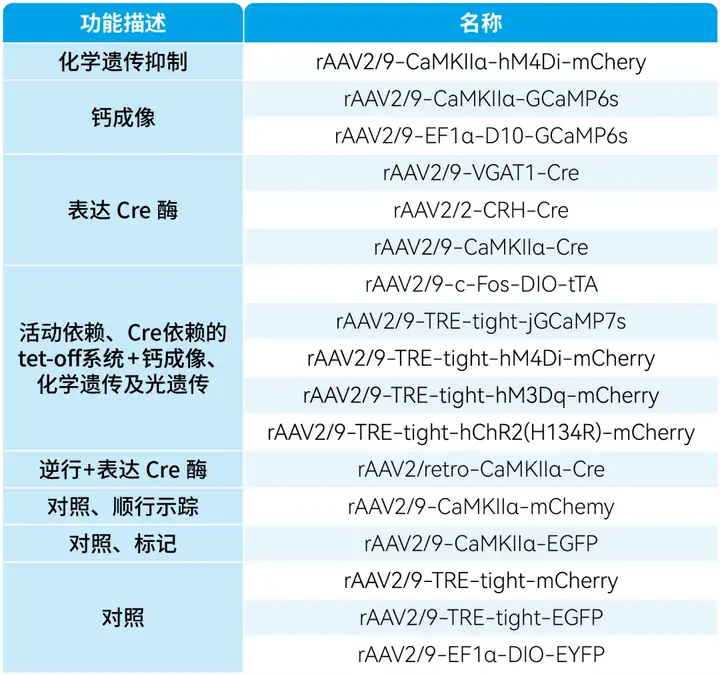
本文使用的病毒产品,列表如下:

了解产品及服务
扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK