2025-07-14 阅读量:833
初级感觉运动皮层(SM1)作为整合初级体感皮层(S1)与初级运动皮层(M1)的功能复合体,传统理论认为其分别独立处理感觉输入与运动输出。然而新证据表明,SM1通过下行投射双向调控感觉与运动功能:S1不仅介导自下而上的感觉感知,还能通过下行通路调控脊髓感觉加工、驱动触须收缩、参与前肢运动适应并调节运动速度;而M1不仅响应疼痛刺激,还在慢性疼痛中发生显著可塑性改变。这种感觉-运动交互作用在皮层刺激镇痛中至关重要——临床及临床前研究均证实,SM1(尤其M1)刺激可有效缓解病理疼痛。然而,SM1调控感觉与运动的功能复杂性仍缺乏细胞与环路层面的解析。现有研究表明,SM1第5-6层锥体神经元发出广泛下行投射至丘脑、脑干及脊髓,构成感觉运动调控的核心通路。值得注意的是,中脑导水管周围灰质(PAG)与延髓头端腹内侧区(RVM)作为痛觉下行调制与运动控制的关键枢纽,已被证实参与感觉运动皮层刺激的镇痛过程。但SM1-PAG/RVM的特异性神经连接如何介导皮层刺激镇痛,以及其如何协同调控感觉与运动功能,仍是亟待解决的核心科学问题。
2025年7月3日,复旦大学脑科学研究院/脑功能与脑疾病全国重点实验室张玉秋教授团队一项新成果以“Descending projection neurons in the primary sensorimotor cortex regulate neuropathic pain and locomotion in mice(初级感觉运动皮层下行投射神经元调控小鼠神经病理性痛与运动功能)”为题发表于Nature Communications杂志。该文章通过病毒示踪、在体双光子成像、光遗传学和化学遗传学操控等实验技术,在SM1脑区鉴定出两群相互独立且分别投射向PAG或RVM的谷氨酸能神经元亚群,即SM1PAG和SM1RVM,并进一步阐明了这两群神经元在缓解神经病理性疼痛及介导运动镇痛中的环路和细胞机制,为优化神经调控镇痛以及开发缓解疼痛的新策略提供了依据。
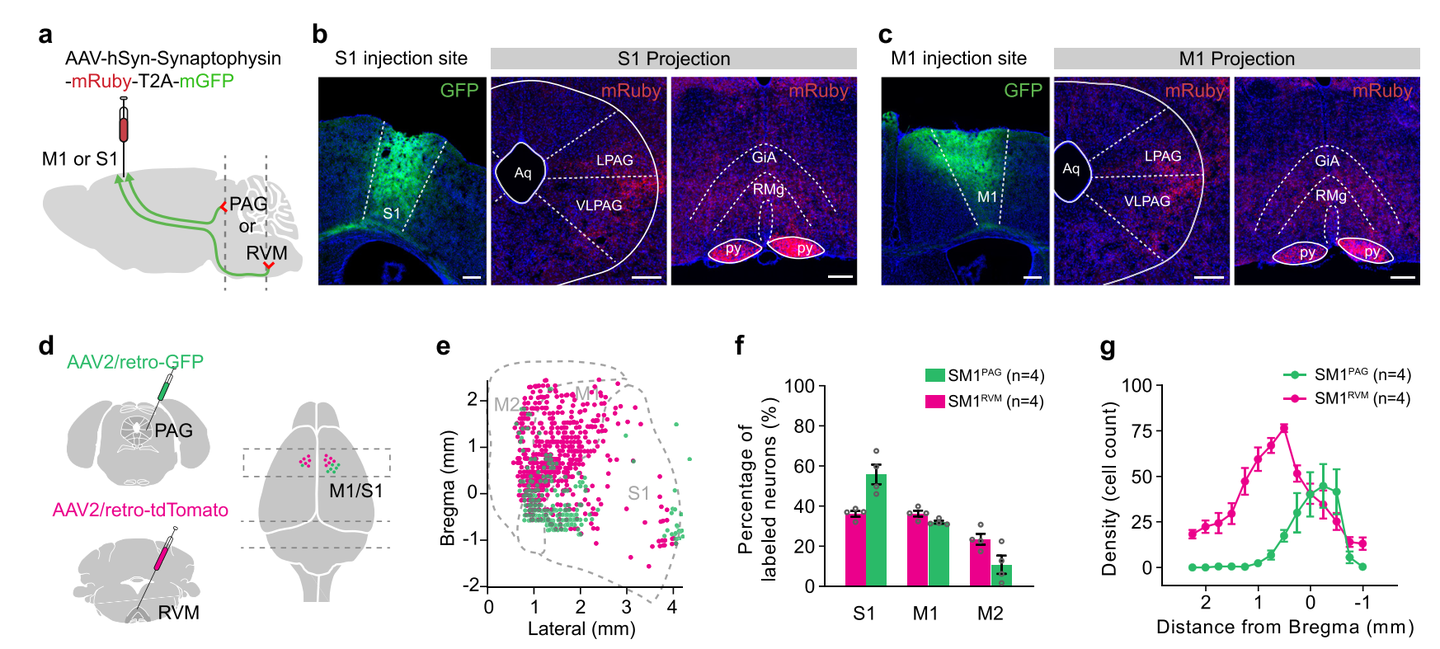
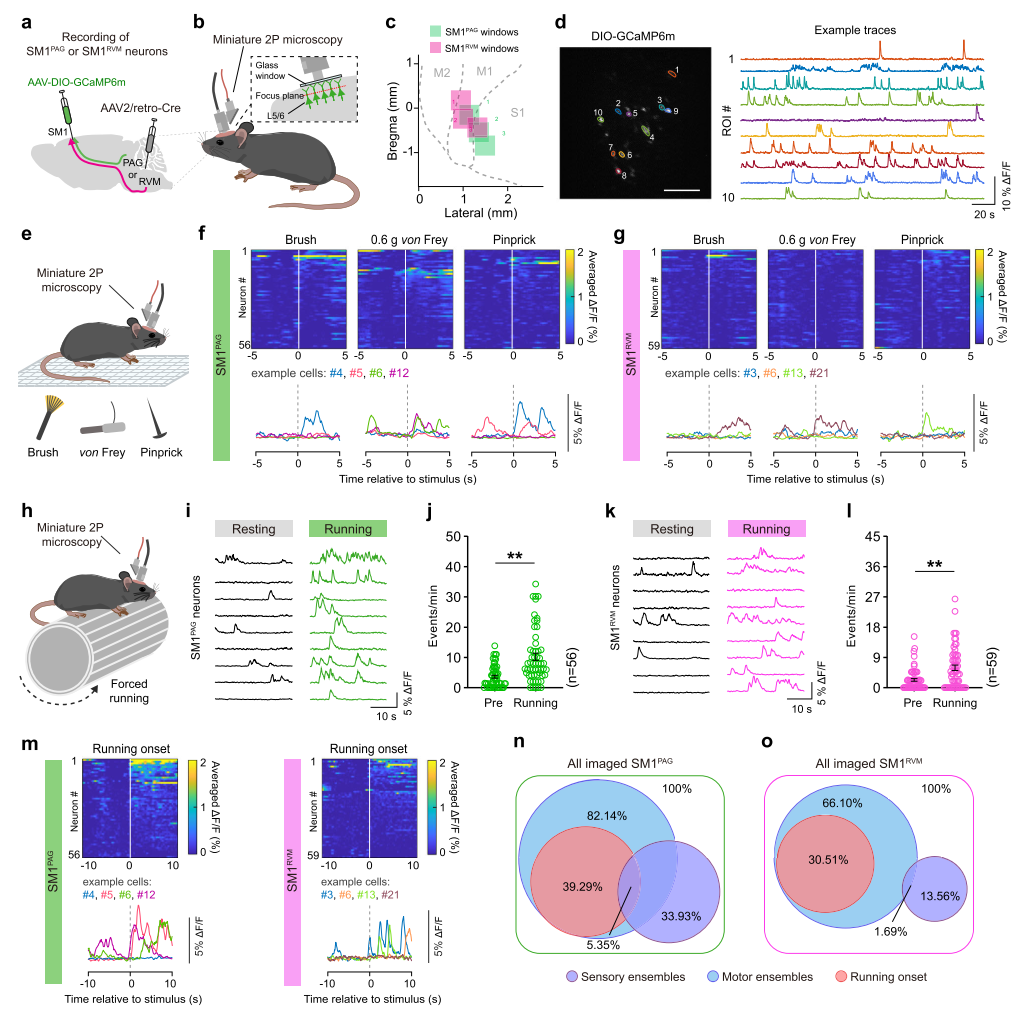
通过在S1或M1脑区分别注射AAV-hSyn-Synaptophysin-mRuby病毒,研究人员首先检测了这两个皮层亚区的下行投射靶点,发现S1和M1均在下游PAG和RVM脑区形成大量的突触连接。进一步通过在PAG和RVM脑区分别注射AAV2/retro-GFP和AAV2/retro-tdTomato病毒后进行组织切片,结果显示SM1脑区深层均有投射向PAG和RVM的神经元存在,且为相互独立的两个谷氨酸能神经元亚群,即SM1PAG和SM1RVM。同时,这两群神经元的空间分布和电生理特性存在一定的差异。
图1 鉴定感觉运动皮层内靶向中脑-延髓的投射神经元亚群
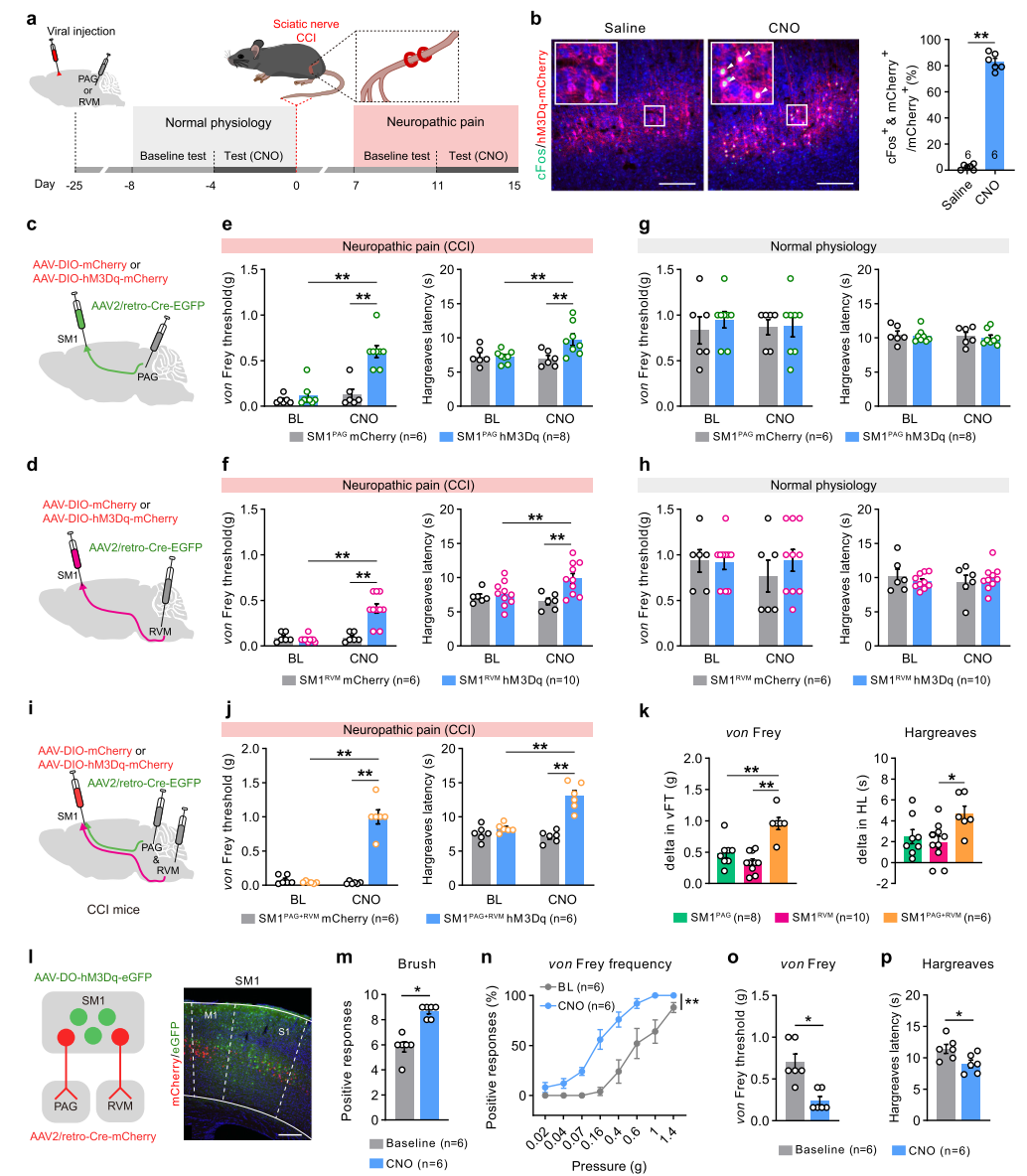
为进一步确定SM1两个神经元亚群对于疼痛的影响,研究人员分别在生理条件下以及神经病理性疼痛造模(坐骨神经慢性压迫)后对这两群神经元进行了化学遗传学激活或抑制。结果显示,激活SM1PAG和SM1RVM神经元均能有效缓解神经病理性疼痛模型小鼠的触诱发痛和热痛过敏。而同时激活这两群神经元则能起到更为强大的镇痛作用,提示这两群神经元可以起到协同镇痛的功能。而激活SM1区域非PAG/RVM投射的神经元则导致正常小鼠出现痛觉敏化。进一步证实SM1PAG和SM1RVM神经元发挥镇痛作用的独特性。而利用环路特异性的光/化学遗传学操控,研究团队证实直接激活SM1→PAG或SM1→RVM投射的末梢,或利用AAV2/1-Cre病毒顺行跨单突触激活PAG或RVM内的突触后神经元同样能有效缓解坐骨神经慢性压迫诱导的触诱发痛和热痛过敏。
图2 激活SM1PAG和SM1RVM亚群均缓解神经病理性疼痛
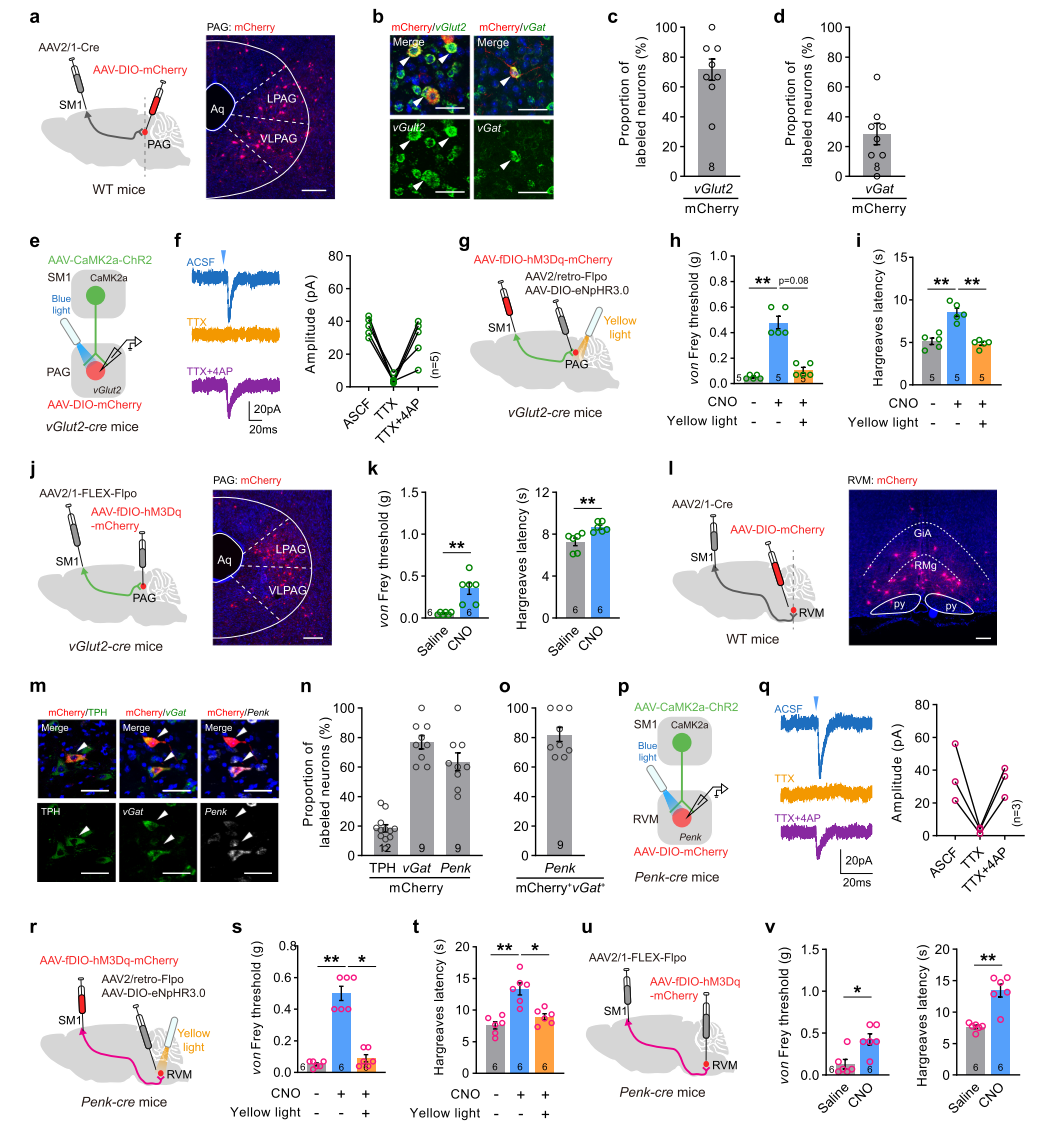
接下来,研究团队对SM1PAG和SM1RVM亚群及其下行环路进行了进一步的解析。结果显示,SM1PAG神经元主要投射向PAG vGlut2阳性的谷氨酸能神经元,而SM1RVM神经元则主要投射向RVM内部一类表达前脑啡肽的Penk阳性神经元。行为学实验证实,抑制PAGvGlut2神经元或RVMPenk神经元可分别阻断激活SM1PAG或SM1RVM亚群带来的镇痛作用。而直接激活SM1突触后的PAGvGlut2或RVMPenk神经元则可有效缓解坐骨神经压迫带来的神经病理性疼痛。提示突触后的PAGvGlut2和RVMPenk神经元在SM1两个神经元亚群介导的镇痛功能中发挥关键作用。
图3 PAGvGlut2和RVMPenk神经元分别介导SM1PAG和SM1RVM亚群的镇痛作用
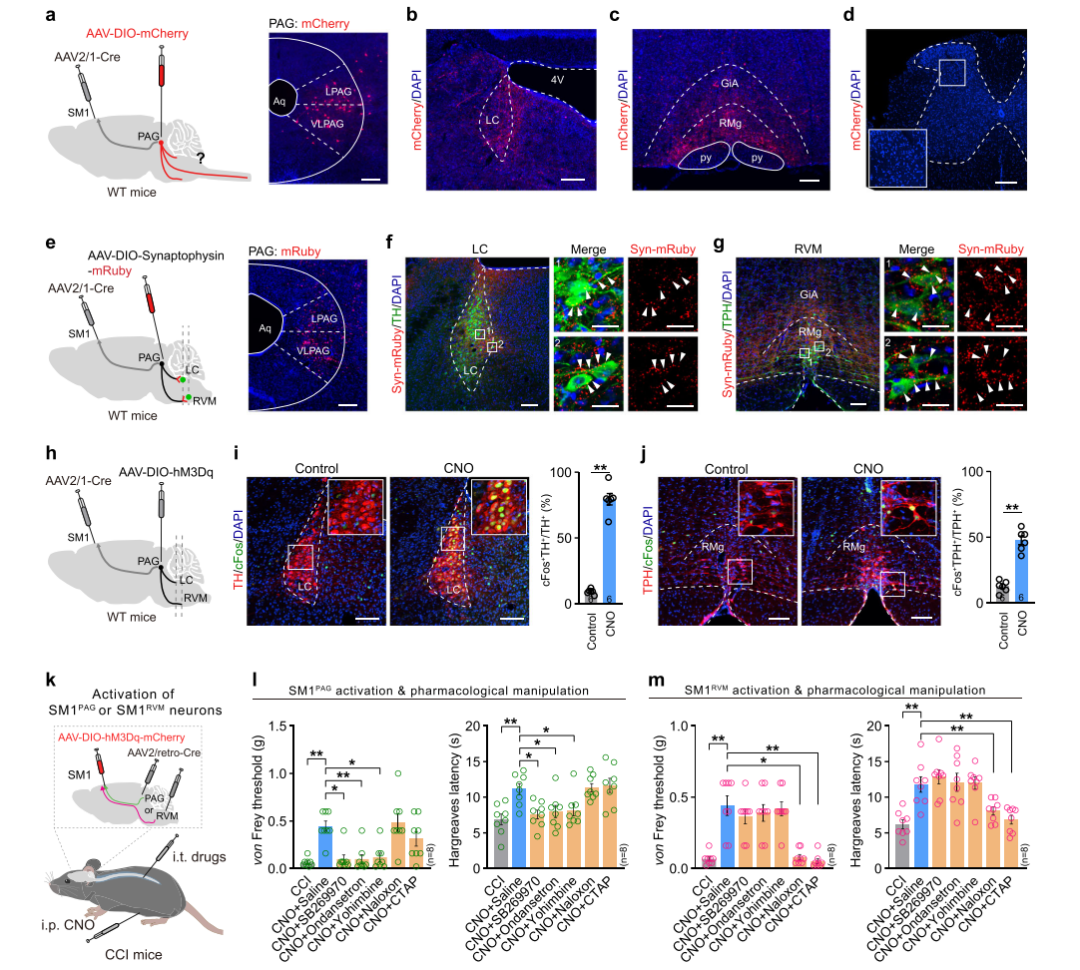
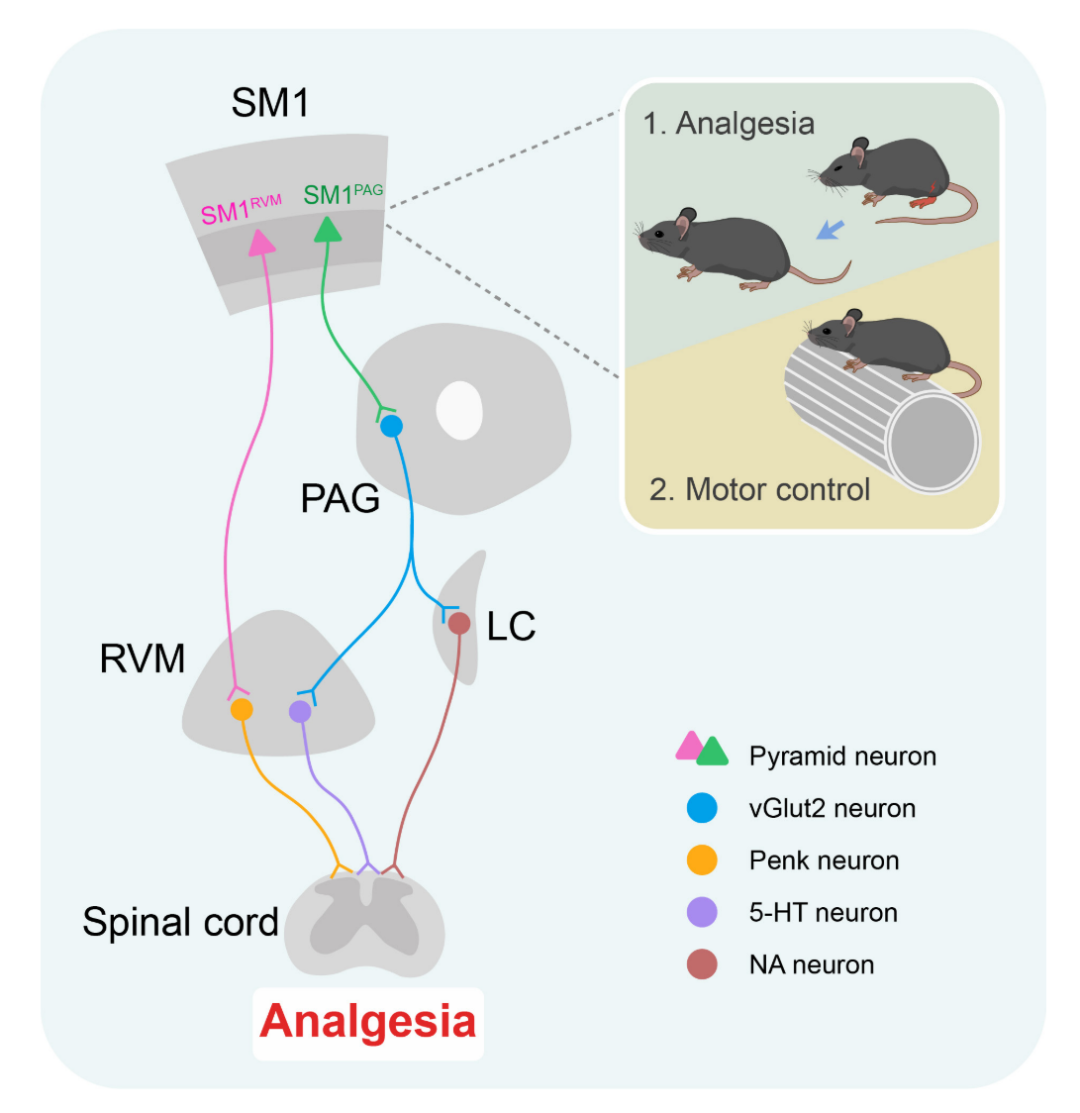
考虑到PAG接受SM1直接投射的神经元并没有到脊髓的直接投射,提示存在其他脑区参与介导了其对痛觉的调控。因此研究人员采用顺行示踪结合化学遗传学激活等方法,证实接受SM1投射的PAG神经元通过下行投射支配蓝斑(LC)去甲肾上腺素能神经元和RVM 5-羟色胺能神经元,最终在脊髓水平通过肾上腺素受体(如α2AR)和5-羟色胺受体(如5-HT3R和5-HT7R)信号抑制伤害性信息传递;而SM1→RVM通路则直接激活RVM内Penk阳性的脑啡肽能神经元,通过向脊髓直接释放阿片肽,进而作用于脊髓μ阿片受体发挥镇痛作用。
图4 SM1PAG和SM1RVM的镇痛作用依赖于不同的细胞和分子机制
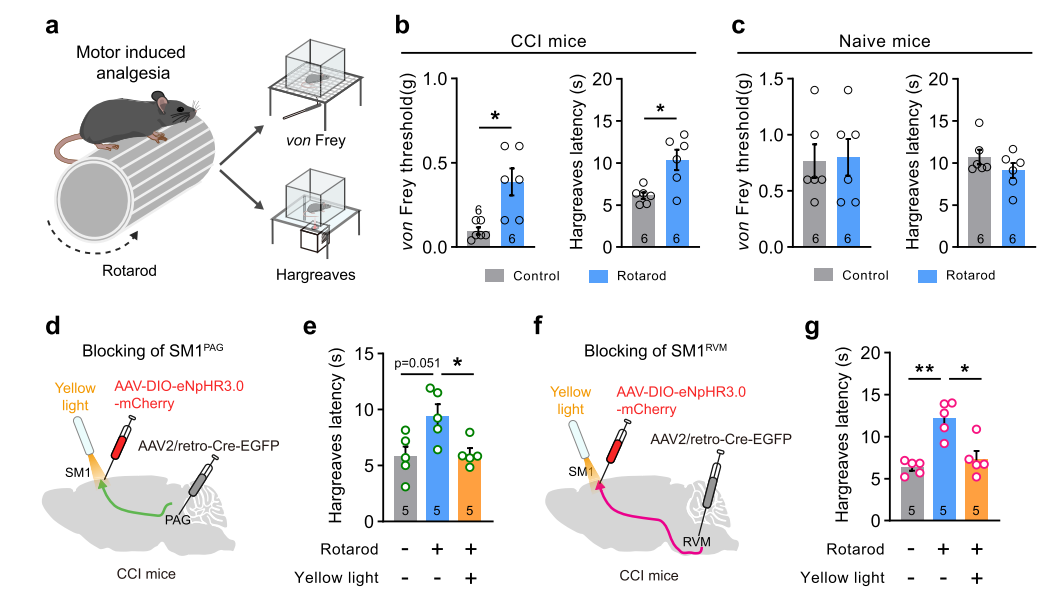
值得注意的是,在前述实验中激活SM1PAG或SM1RVM神经元并不影响小鼠在正常生理状态下的基础痛阈。那么这两群神经元在生理条件下的主要功能是什么呢?为了回答这个问题,研究团队采用在体双光子成像技术在自由活动的小鼠上进行实验,证实这两群SM1神经元在正常生理状态下对躯体感觉刺激反应微弱,但却在运动中(如转棒测试)被强烈激活。而进一步的化学遗传学抑制实验证实选择性抑制SM1PAG或SM1RVM神经元对躯体感觉刺激诱发的反射性行为无影响,但是对小鼠的精细运动和运动协调能力造成了明显损害。
图5 SM1PAG和SM1RVM的双光子成像
为什么生理情况下介导运动调控的神经元却可以缓解神经病理性疼痛呢?该研究进一步揭示了这两群SM1神经元在“运动镇痛”(Exercise-induced analgesia)中所扮演的重要角色。实验证明,执行运动任务(如转棒)能有效缓解小鼠神经病理性痛,而这种镇痛作用可被选择性抑制SM1PAG或SM1RVM神经元所阻断。提示运动的确可以通过激活SM1这两群神经元来发挥镇痛的功能。
图6 抑制SM1PAG">或SM1RVM">神经元阻断运动带来的镇痛作用
总结
综上,该研究基于下行至脑干的投射区域在SM1脑区鉴定出两群独立的神经元亚群。激活这些亚群及其下行投射通路,可独立且协同地缓解坐骨神经慢性压迫(CCI)诱导的神经病理性疼痛。研究结果表明,这种具有功能代偿性和冗余性的神经组织系统对动物的生存至关重要——从进化角度看,这一机制可以协助动物完成关键运动行为同时抑制疼痛,以提高生存几率和安全保障。该研究为感觉与运动系统的交互提供了新的见解,并表明靶向SM1-脑干环路以及5-羟色胺能、去甲肾上腺素能和阿片肽能信号系统的策略或许能改善慢性疼痛的治疗效果。
图7 工作模式图
复旦大学脑科学研究院张玉秋教授为本文通讯作者,张玉秋课题组博士后王国宏为本文第一作者。张玉秋课题组侯心宇、刘慧珠、周子睿、吕粟粟、易蓝星、李荟等同学参与协助课题完成。该研究得到了科技部2030—“脑科学与类脑研究”重大项目和国家自然基金等项目的支持。
通讯作者介绍:
张玉秋,1998年获西安医科大学(现西安交通大学医学院)博士学位,1998-2000年在上海医科大学(现复旦大学上海医学院)从事博士后研究,曾获全国优秀博士后。2000年加入复旦大学神经生物学研究所任副教授;2001年12月起任复旦大学教授至今,期间在美国辛辛那提大学分子与细胞生物学系进行合作研究。历任复旦大学神经生物学研究所副所长、常务副所长、所长。曾获得国家杰出青年科学基金、上海市领军人才。先后获得上海市三八红旗手、新中国60年上海百位杰出女教师,全国三八红旗手、十佳全国巾帼建功标兵等荣誉称号。担任中国神经科学学会副理事长、上海神经科学学会副理事长。现任复旦大学脑科学研究院副院长。近年来,主要从事慢性痛中枢敏化和痛情绪制研究,在国际痛觉和神经科学研究领域的学术期刊Nature Neurosci, Neuron, Anesthesiology, PAIN, J Neurosci等发表研究论文80多篇。曾获省部级科学技术奖六项(第一完成人2项,第二完成人1项,第三完成人2项)。已培养博士后、博士研究生和硕士研究生数十名,有多名研究生获得各类研究生学术奖励、优秀博士生创新基金和上海市优秀博士学位论文。2019年带领研究团队获得复旦大学首届十佳“三好”研究生导学团队称号。
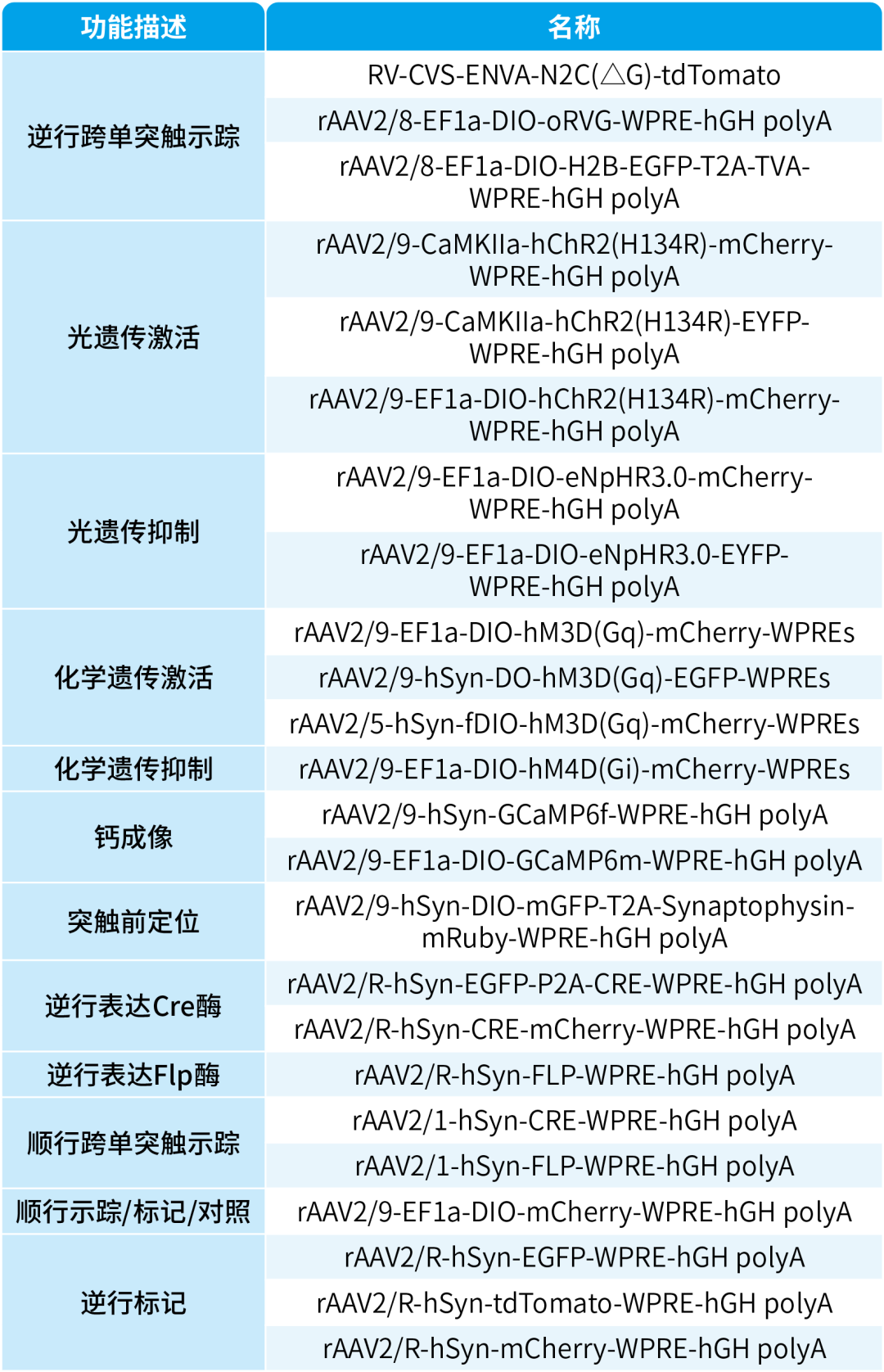
本文使用的来自枢密科技的病毒产品,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK