2025-07-07 阅读量:1255
破译复杂脑环路的关键在于能够识别编码特定行为或脑功能的神经通路。假设已知某个脑区(“X”)参与特定的行为/功能,要确定X下游的哪些神经通路介导该行为/功能仍然充满挑战。传统的顺行示踪方法可识别X区神经元投射的所有目标区域。然而,对于这些区域中的每一个(“Y1”到“Yn”),都存在这样的可能性:其中包含不接收来自X的直接输入、且与研究关注的X依赖性功能无关的神经元。而这些神经元与那些直接参与目标功能的神经元在分子或遗传上未必存在差异。因此,为精确追踪所研究的X依赖性功能背后的神经通路,有必要在相关的下游核团(Y)中识别出接收来自X直接输入的那个神经元亚群。这要求仅在选定的目标区域内,对突触后神经元进行传入依赖性的标记。
标记这些由输入定义的突触后神经元的一个直接策略是:在源头区域应用顺行跨突触示踪剂,同时在选定的目标区域实现依赖于该示踪剂的转基因表达。这将允许对从源核团起始的、特定的二级下游通路进行功能操控。跨细胞/跨突触病毒示踪剂可成为以上述方式绘制功能环路的潜在有力工具。然而,虽然顺行跨突触工具如单纯疱疹病毒(HSV)和水疱性口炎病毒(VSV),具有跨神经元/跨突触传播的能力,但这些病毒的神经毒性及其跨越多个连续突触的不可控传播,在很大程度上限制了它们在更精确绘制环路中的应用。有研究表明AAV1可沿着轴突顺行运输。然而,关于其潜在跨神经元/跨突触传播能力的证据目前尚不清楚。
因此,2016年12月15日,美国南加州大学凯克医学中心齐尔卡神经遗传研究所张砺教授团队在Neuron期刊(IF=13.974)发表题为“AAV-Mediated Anterograde Transsynaptic Tagging:Mapping Corticocollicular Input-Defined Neural Pathways for Defense Behaviors”研究论文,首次证实腺相关病毒AAV1可顺行跨单级突触传播。该研究发现,突触前神经元转导AAV1-Cre,能够有效且特异地驱动选定突触后神经元靶点中Cre依赖的转基因表达。因此,该技术可用于对后者(即由输入定义的神经元群体)进行轴突追踪和功能操控。将其应用于上丘(SC)的研究揭示:接收来自听皮层和视皮层的皮层-上丘投射的不同SC神经元亚群,分别特异性地驱动逃跑(flight)和僵直(freezing)这两种不同类型的防御行为。
1.AAV1-Cre的顺行跨神经元传播
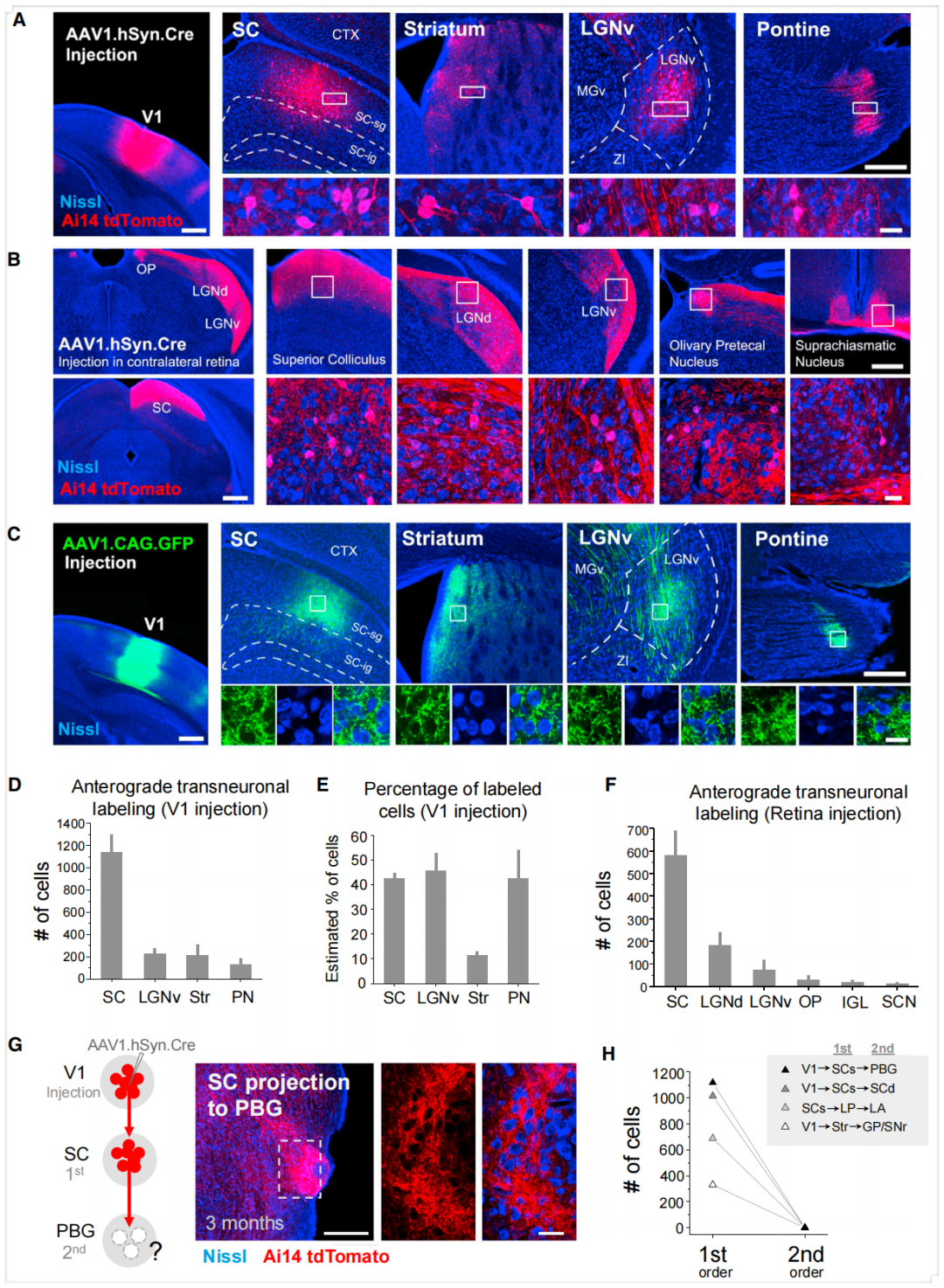
为测试AAV是否存在顺行跨神经元运输,作者将AAV2/1-hSyn-Cre注射到Ai14(Cre依赖的tdTomato报告基因)小鼠的初级视觉皮层(V1)中。注射后4周,研究人员在所有已知受V1直接支配的区域,包括上丘(SC)、纹状体(Str)、腹外侧膝状体核(LGNv)和脑桥核(PN),均观察到表达tdTomato的胞体与tdTomato标记的轴突末梢混杂在一起。由于这四个区域并不投射回V1,这些区域中tdTomato阳性胞体的存在只能解释为Cre病毒从V1轴突向其靶结构中的神经元发生了跨神经元扩散。AAV1-Cre也能够以较低的效率逆行扩散到突触前神经元,导致突触前神经元中出现Cre依赖的转基因表达。因此,在与V1存在双向连接的脑区(如,背外侧膝状体核,LGNd),胞体的tdTomato标记可能同时源于Cre病毒的顺行和逆行跨神经元运输。由于存在这种模糊性,这些区域未在当前研究中予以考虑。
为进一步确认AAV1的顺行跨神经元扩散,研究者将AAV1-hSyn-Cre单侧注射到Ai14小鼠的视网膜中,并在已知接收视网膜神经节细胞(RGC)输入信号的脑区检测了tdTomato表达。在所有检测区域,包括SC、LGNd、LGNv、橄榄顶盖前核(OP)和视交叉上核(SCN),都观察到了tdTomato阳性胞体。同样,由于上述任何中枢结构都不投射回视网膜,胞体的tdTomato标记只能是病毒从RGC轴突到靶细胞的顺行跨神经元扩散的结果。
有趣的是,尽管表达GFP或视紫红质通道蛋白2(ChR2)的AAV被广泛应用,但AAV的顺行跨神经元运输此前并未被广泛报道。研究人员在将AAV1-CAG-GFP注射到V1后4周,尽管存在强标记的轴突末梢,但在受V1直接支配的区域并未发现任何GFP阳性胞体。这一结果表明跨神经元扩散的效率相对较低。也就是说,只有少量病毒颗粒可能从初始宿主细胞发生跨神经元运输,进而导致下游神经元中的GFP表达极其微弱,可能低于检测阈值。因此,在任何应用AAV介导的顺行跨神经元标记时,都需要一个扩增步骤,如利用Cre来解锁稳定的转基因表达。
作者统计了每个感兴趣的目标结构中顺行标记的神经元总数。对于V1注射,SC包含的标记神经元数量最多,其次是LGNv、Str和PN。将tdTomato标记的神经元数量与相同局部区域内尼氏(Nissl)染色的细胞体(深蓝色)数量进行了比较。研究者发现,在SC、LGNv和PN中,顺行标记细胞的百分比达到了约40%,这表明接收到跨神经元运输的Cre病毒的神经元数量相对较高。对于视网膜注射,SC同样包含数量最多的顺行标记神经元,其次是LGNd和LGNv。OP、膝状体间小叶(IGL)和SCN也包含少量标记神经元。在已知受V1或视网膜轴突直接支配的区域之外,未观察到任何tdTomato阳性胞体,这表明病毒不会进一步扩散到二阶下游结构。如图2G所示,虽然SC神经元通过V1顺行运输的AAV1-Cre解锁的tdTomato表达被标记,但在受SC直接支配的旁二叠体核(PBG),即使在注射后3个月,也未发现tdTomato阳性胞体。此外,在检查的其他几个二阶核团中也未发现tdTomato标记的胞体。
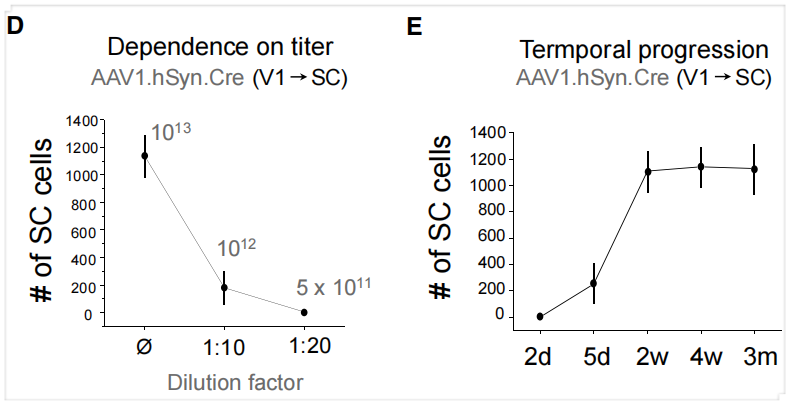
研究人员进一步实验发现,顺行跨神经元传播需要相对较高的病毒滴度,因为随着AAV1滴度降低,标记神经元数量急剧减少。该顺行跨神经元标记最早在注射后5天可观察到,注射后2周完全显现,并稳定保持长达3个月。
图1.AAV1-Cre顺行跨神经元运输
2.输入定义的SC神经元亚群输出投射图谱
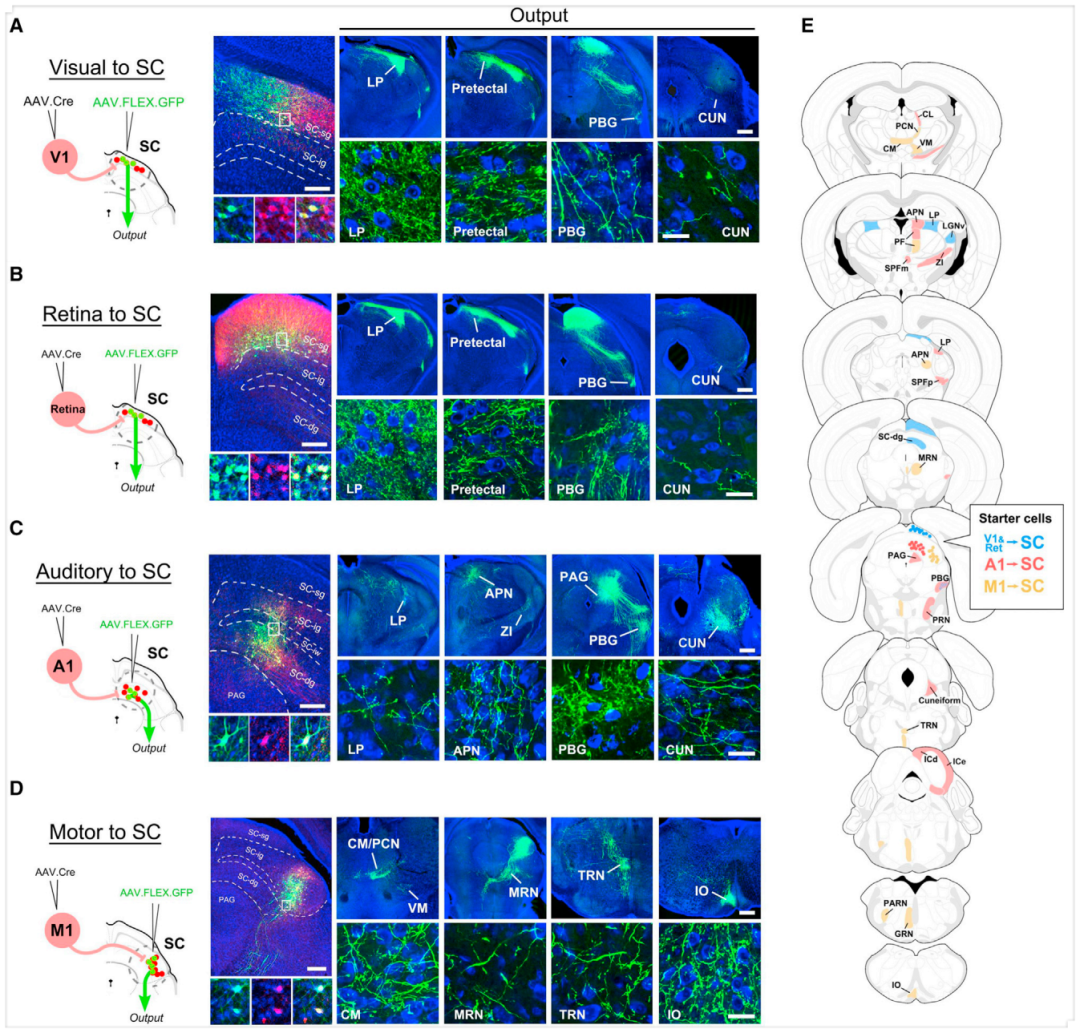
AAV-Cre的顺行跨突触特性使其可用于绘制具有特定突触前输入源(即输入定义)的神经元群体的轴突投射图谱。为验证此构想,作者采用两步病毒注射策略,并选择SC作为靶结构——因其接收来自视网膜及多个皮层区域的输入,且这些输入终止于SC的不同分层。首先在Ai14小鼠V1注射AAV1-hSyn-Cre,以标记接收V1输入的SC神经元。数日后,在SC注射AAV1-CAG-FLEX-GFP。注射后4周,作者观察到SC浅灰质层(SC-sg)内的tdTomato阳性神经元中GFP呈现强烈表达。100%的GFP阳性神经元同时呈tdTomato阳性,这与Cre依赖的GFP和跨突触传递的Cre病毒共转导的结果一致。研究人员检测了这群特定SC-sg神经元向各靶结构的远程轴突投射,发现最显著的轴突标记位于丘脑外侧后核(LP),额外标记见于顶盖前区和PBG。
接着研究者考察接收RGC投射的SC神经元(其输入同样靶向SC浅层)。采用与V1实验类似的配对注射策略(视网膜与SC),获得一组特异性位于SC-sg的GFP阳性神经元。它们的轴突投射靶区与V1输入定义群体高度吻合,提示视网膜与V1可能靶向相同的SC神经元群。
进一步研究特异性接收初级听皮层(A1)和初级运动皮层(M1)输入的SC神经元群。向A1与SC配对注射后,在SC深灰质层(SC-dg)内侧观察到大量GFP阳性细胞,少量散在于上覆的中灰质层(SC-ig)。此标记模式符合已知的A1向SC投射的分布特征。A1输入定义的SC神经元轴突输出明显不同于浅层SC神经元:其主要投射至PBG、导水管周围灰质(PAG)、楔形核(CUN)等区域,而向LP的输入极其稀疏——这与浅层SC神经元向LP的强投射形成鲜明对比。与之相比,M1与SC的配对注射标记了一群局限于SC-ig外侧部的神经元。该SC神经元群的轴突输出模式既不同于A1定义群体,也区别于V1/视网膜定义群体[主要投射至中脑网状核(MRN)、下橄榄核复合体(IO)及被盖网状核(TRN)等区域]。
为系统总结输入定义SC神经元亚群的轴突输出特征,研究者检测了所有含GFP阳性轴突的脑片,并在对应图谱切片上标注存在可观察突触前末端膨大(即突触小体)的区域。接收V1和视网膜输入的SC神经元表现出高度相似的输出谱;而由A1和M1输入定义的群体则呈现彼此不同且区别于V1/视网膜群体的输出谱。如,与V1和A1定义群体不同,M1定义的SC神经元表现出显著的向对侧靶区的投射,尤其集中于脑干后部,如TRN、巨细胞网状核(GRN)和IO。综上,这些结果证明AAV-Cre介导的跨突触标记技术可用于绘制特定脑区内具有不同输入输出模式的投射神经元类别图谱。
图2.SC中输入定义神经元群的轴突输出投射图谱
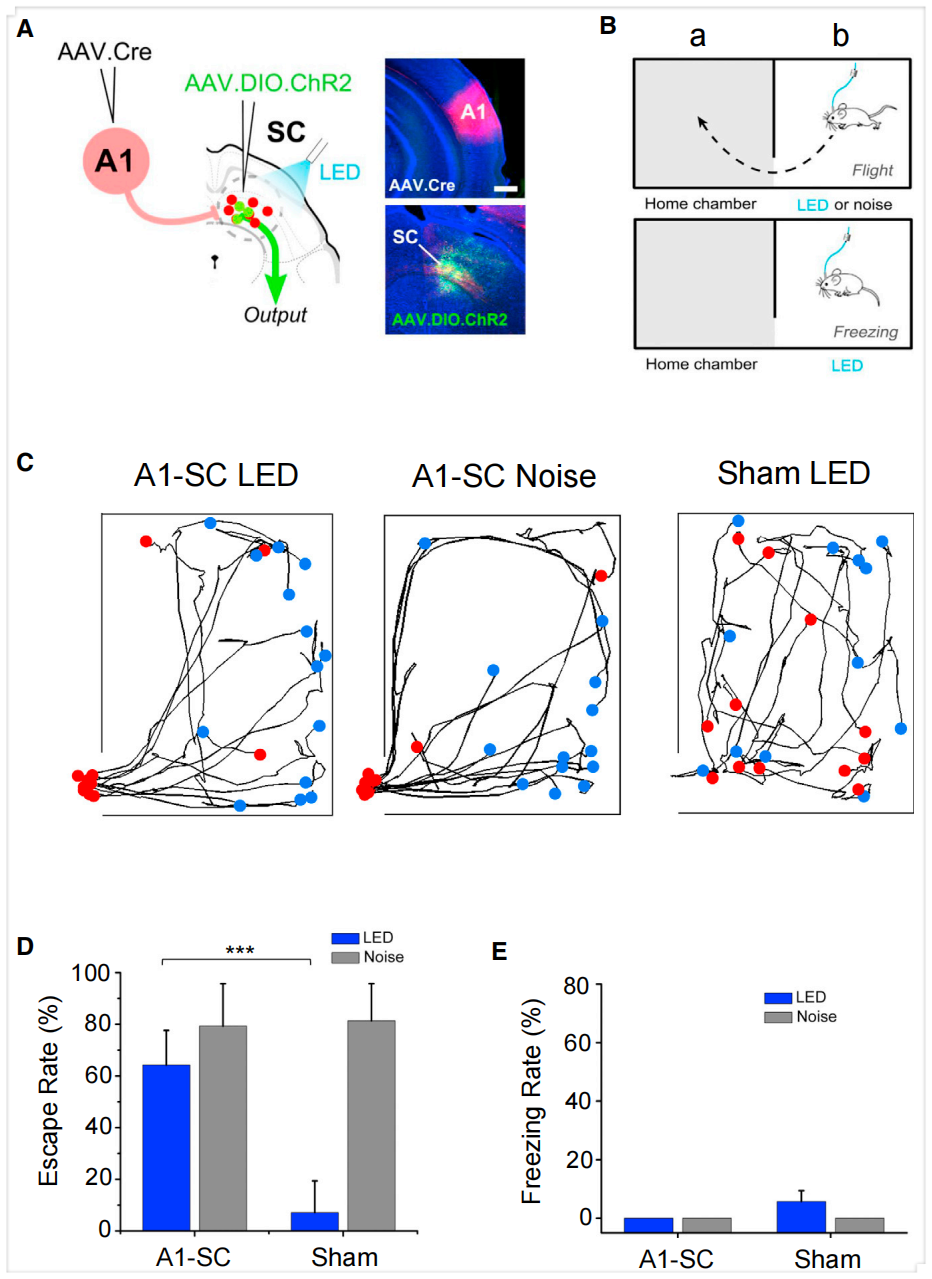
3.输入定义的SC神经元亚群具有不同行为功能
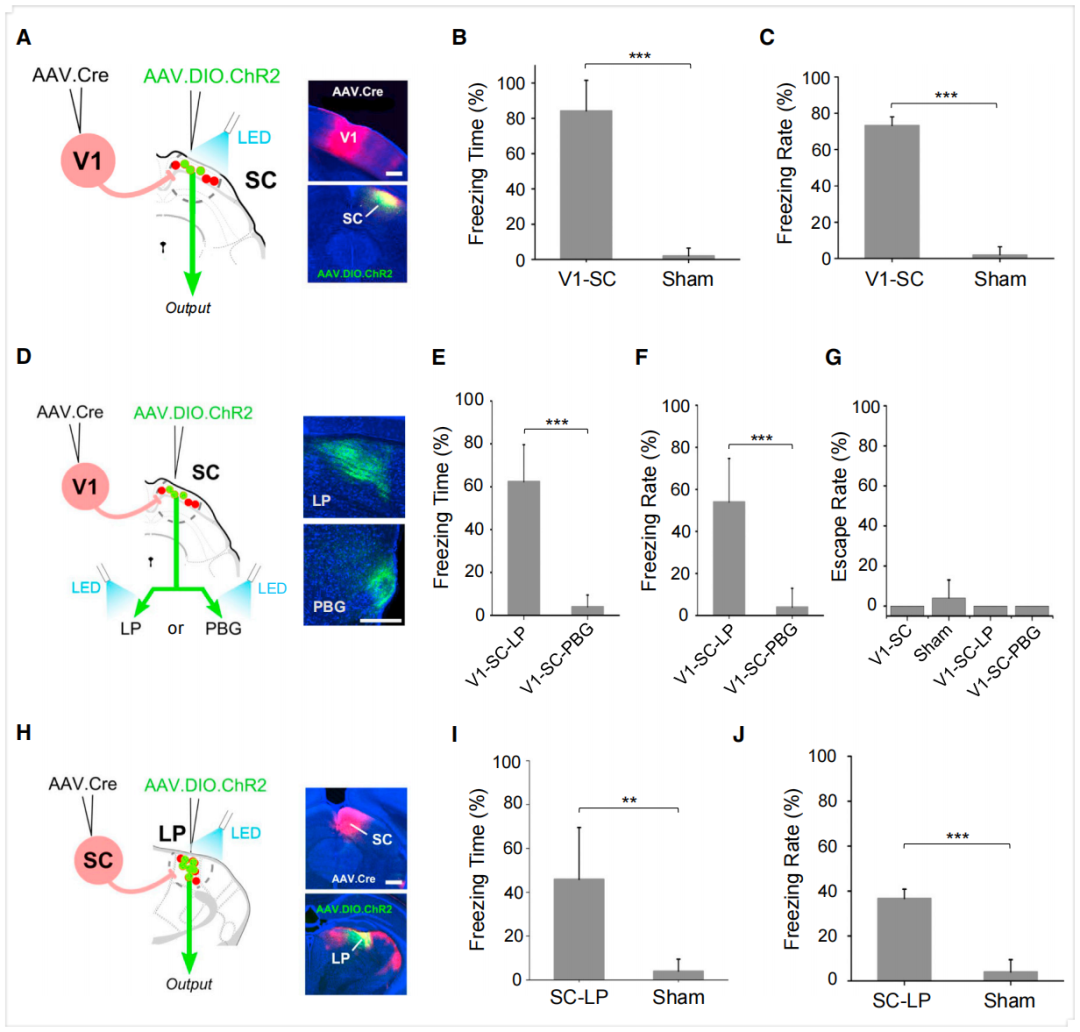
SC整合多种感觉与运动信息,参与调控定向行为及先天防御行为(如僵直和逃跑)。鉴于接收V1与A1输入的SC神经元亚群具有不同的下游靶区谱,作者推测二者可能分别驱动不同的SC介导行为。为验证此假说,研究人员通过配对注射在A1或V1注射AAV1-Cre,同时在SC注射AAV1-EF1α-DIO-ChR2-EYFP,使ChR2分别在SC深层或浅层神经元中实现Cre依赖的表达。随后通过植入光纤对清醒自由活动小鼠施加蓝光脉冲刺激(20 Hz,持续5秒)激活SC神经元。采用双室装置测试僵直与逃跑反应:小鼠先在“家”室适应10分钟,移除隔门后允许其探索相邻“新”室。当小鼠探索新室时,光激活SC并监测其逃回家室或僵直行为。结果显示,A1输入定义SC深层神经元表达ChR2的小鼠中,光激活诱发显著的逃跑行为反应,而对照小鼠无此现象(S2注射AAV1-FLEX-GFP)。此光激活效应与强噪声刺激(5秒,70 dB声压级)效果相似——单独施加噪声即可在多数试验中诱发逃跑行为反应。这些小鼠在任何试验中均未出现僵直行为反应。相反,V1输入定义SC浅层神经元表达ChR2的小鼠均表现出光激活诱导的僵直行为反应,而对照组则无此现象。所有小鼠在光激活后均未出现逃跑行为。这些结果揭示了SC浅层与深层神经元在调控两种不同防御行为中的功能分化。
本文示踪结果表明LP是V1输入定义SC神经元的主要轴突靶区,且顺行跨突触标记与逆向标记(CTB 488)联合证实大部分(66%)V1输入定义SC神经元投射至LP。因此研究者探究SC-sg激活诱发的僵直行为是否通过LP介导。结果显示,光遗传激活自由活动小鼠SC-sg神经元在LP的轴突末梢可诱发类似的僵直行为反应(强度稍弱),表明LP参与驱动SC介导的僵直行为。相比之下,激活SC在PBG的轴突末梢不诱发僵直行为,提示PBG不参与此行为。此外,上述末梢激活均未诱导逃跑行为。
然而,在轴突末梢激活过程中存在局限:可能发生对侧支靶点的非特异性逆向刺激,导致非预期SC靶区的激活。此外,光纤发出的LED光可能激活途经LP投射至其他靶区的ChR2标记轴突,二者均会干扰结果解读。为克服此限制,研究人员利用AAV-Cre跨突触标记在SC输入定义LP神经元中特异性表达ChR2:向SC注射AAV1-Cre,同时向与SC存在单向连接的LP注射AAV1-DIO-ChR2。选择性激活自由活动动物的ChR2阳性LP神经元可诱发与SC-LP投射激活相当的僵直行为。该结果为LP作为SC-sg神经元激活产生僵直反应的下游介质提供了有力支持。
图3.A1输入定义SC神经元驱动先天逃避行为
图4.V1输入定义SC神经元驱动僵直行为
总结
病毒工具可通过跨突触扩散特性显著促进神经环路的组织架构与功能解析。结合条件性表达策略(即两步病毒注射法),AAV1的跨突触运输特性能够揭示:接收不同皮层-上丘输入的特定SC神经元亚群的输出路径;并证明这些亚群在驱动不同类型防御行为中的独特功能作用。
2020年4月15日,该团队在Journal of Neuroscience发表题为“Synaptic Specificity and Application of Anterograde Transsynaptic AAV for Probing Neural Circuitry”的研究论文,该研究证实AAV1可优先靶向突触后连接神经元,且其跨突触传播高度依赖突触神经递质的释放。研究显示,除谷氨酸能通路外,AAV1还可通过GABA能突触传播至兴奋性和抑制性神经元,但在神经调质投射通路(如5-羟色胺能、胆碱能及去甲肾上.腺素能通路)中几乎不传播。此外,AAV1可经大脑多个区域的长程下行投射有效转导脊髓神经元。AAV1的跨突触传播不限于Cre表达型AAV1——在Flp报告小鼠(Frt-GFP)中,使用Flp表达病毒(AAV1-hSyn-Flp)同样有效。因此,AAV1介导的跨突触标记可扩展至多种重组酶系统,为基于多标准的细胞类型交叉筛选提供技术支持。
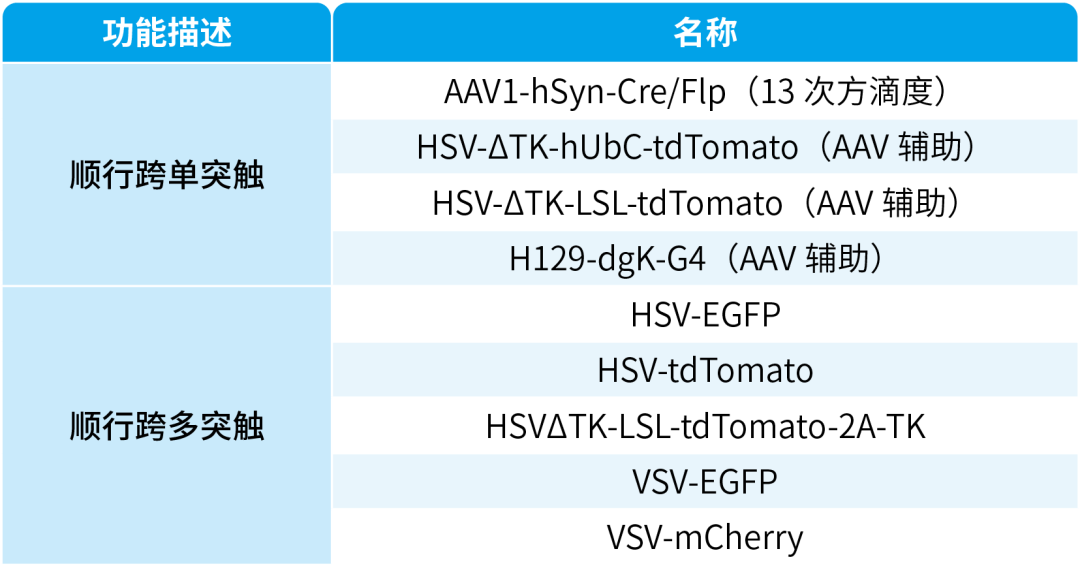
我司可提供顺行跨突触病毒工具,列表如下:

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK