2025-02-25 阅读量:1152
抑郁障碍是一种全生命周期均可发病的常见精神疾病和情感障碍。目前“卡脖子”的临床难题之一是缺乏客观的诊断标记。东南大学张志珺教授团队近年来聚焦于多层面分子诊断生物标记物筛选确定和功能验证,并推动分子靶向干预和精准神经调控转化应用。该团队前期研究发现,脑源性维生素D结合蛋白(Vitamin D binding protein,VDBP)在抑郁障碍患者背外侧前额叶皮层和抑郁样行为模式小鼠的同源功能脑区前边缘皮层(Prelimbic cortex,PrL)小胶质细胞(Microglia,MG)中选择性增加,并确定其为候选分子诊断标记(J Affect Dis, 2020;Genes & Diseases, 2024)。
最近,东南大学张志珺教授和孔岩副教授团队联合中科院深圳先进院/深圳理工大学在Advanced Science期刊上发表了题为“Microglia-Derived Vitamin D Binding Protein Mediates Synaptic Damage and Induces Depression by Binding to the Neuronal Receptor Megalin”的研究论文。该研究创新性发现并首次报道情感环路核心脑区PrL区MG源性VDBP通过结合神经元受体巨蛋白(Megalin)调控SRC酪氨酸激酶信号传导通路导致神经元凋亡和突触受损诱导小鼠抑郁样行为发生,揭示了VDBP介导的MG和神经元交互作用途径与机制,证实了脑源性VDBP是抑郁障碍分子诊断生物标记物,为正在研制的分子靶向干预提供了充分的实证。

该团队基于基因表达数据库荟萃分析发现,抑郁障碍患者前额叶皮层VDBP mRNA表达显著增高。已有研究表明,VDBP是一种进化保守的多功能α2-球蛋白,循环中的VDBP主要产生于肝实质细胞,仅2-5%的VDBP即可完成80%以上的转运维生素D的功能,尤为重要的是,VDBP基因全敲后并不出现维生素D缺乏表型。另外,极少的研究发现大鼠下丘脑核团可产生VDBP,也有报道显示胎儿和成人脑组织有VDBP基因表达,因此,脑源性VDBP的非转运维生素D的功能如何参与抑郁的发生,成为了本项目拟揭示的主要科学问题。
本研究首先完成了VDBP在野生型小鼠的全脑mapping(分布图谱分析),结果显示前、中、后脑共30个区域均表达VDBP,其中慢性不可预知温和应激(Chronic unpredictable mild stress, CUMS)诱导后,敏感型抑郁样行为小鼠的4个情感环路核心脑区(PrL区、海马、伏隔核、下丘脑)的VDBP相较对照组小鼠和CUMS抵抗型小鼠显著高表达。进一步分析发现,PrL区MG源性VDBP mRNA和蛋白水平均选择性升高。
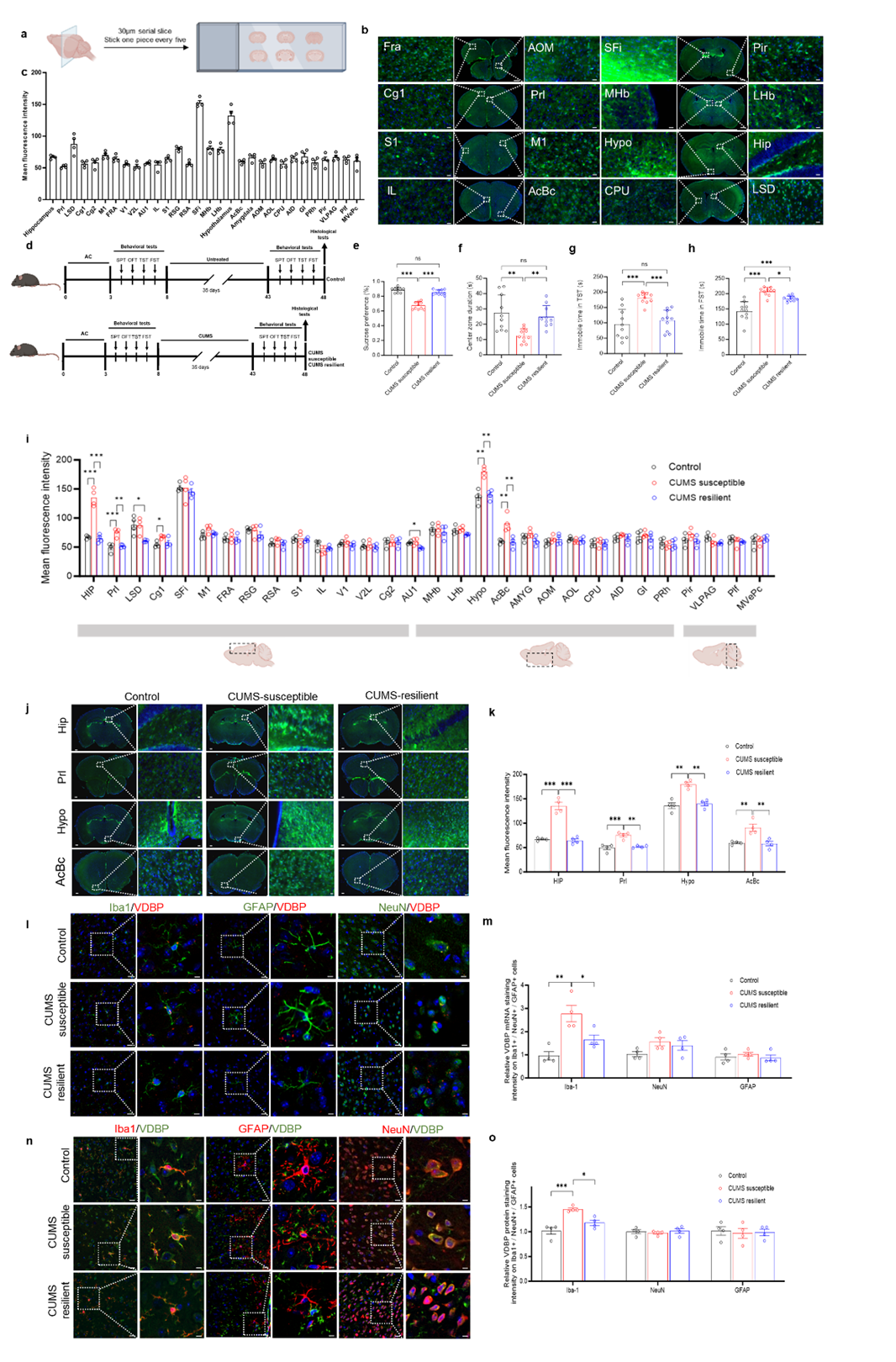
图1. 对野生型及CUMS应激小鼠VDBP全脑表达进行分析
过表达MG源性VDBP能否导致神经元受损,进而诱导小鼠抑郁样表型?系列离体细胞实验经充分正反验证后证实,地塞米松应激可诱导MG源性VDBP的mRNA、蛋白水平和分泌量均升高,并与VDBP过表达MG一致,其培养基可导致神经元活性减低、凋亡增加、突触蛋白减少和树突结构受损;反之,靶向敲减MG源性VDBP可逆转上述神经元突触损伤。整体模式动物实验进一步证实,采用MG特异表达Cre重组酶小鼠(Cx3cr1-CreERT2)结合腺相关病毒脑立体定位注射,建立的PrL区MG源性VDBP条件性过表达小鼠,可出现抑郁样行为,并加重CUMS诱导的小鼠抑郁表型;反之,通过CRISPR-Cas9技术建立的VDBPfl/fl小鼠与Cx3cr1-CreERT2小鼠杂交,并经他莫昔芬诱导成功构建的条件性敲除MG源性VDBP小鼠,可显著抵抗CUMS诱导的抑郁样行为,并改善CUMS诱导的突触蛋白减少、树突结构损伤以及Prl区离体脑片电生理测定的微小兴奋性突触后电流(Miniature excitatory postsynaptic current,mEPSC)频率下降,即突触传递能力减退。这些结果一致性提示了条件性敲除MG源性VDBP可发挥抗抑郁作用。
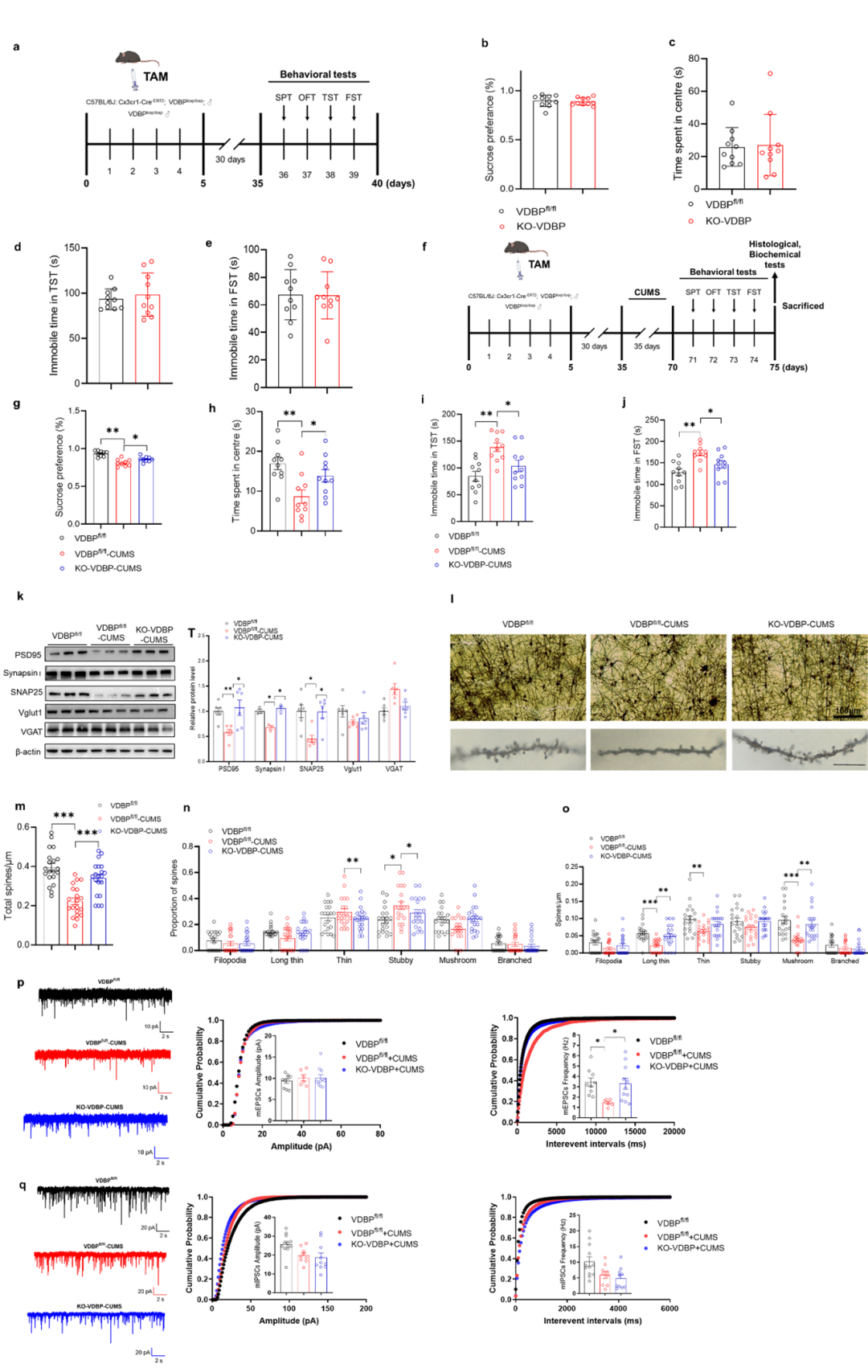
图2. MG源性VDBP条件性敲除小鼠表现出对CUMS应激抗性
那么,VDBP是如何介导MG和神经元实现交互作用(crosstalk)的呢?先前研究已证实,循环中的VDBP可作为配体,与多种器官和组织中的细胞膜受体巨蛋白结合,通过增加细胞内吞作用激活多个下游信号通路,发挥重要的生物学作用。然而,VDBP与神经元受体巨蛋白的结合尚未见报道。因此,首先在离体细胞体系,结合采用GST Pull-down(谷胱甘肽S-转移酶(GST)下拉实验)、邻近连接技术分析(Proximity ligation assay, PLA)和荧光标记蛋白结合受体阻断实验,首次证实了VDBP可直接结合神经元表面受体巨蛋白,并筛选出VDBP和Megalin结合后显著影响下游SRC非受体型酪氨酸激酶信号传导通路,导致神经元凋亡和突触受损,而巨蛋白受体阻断剂RAP可逆转之。继而,聚焦离体细胞证实的机制,靶向敲减小鼠PrL区神经元受体巨蛋白确实可改善MG源性VDBP过表达引起的小鼠对CUMS诱导抑郁样行为的敏感性增加、突触蛋白减少、树突结构损伤、mEPSC频率下降,并证实其是通过逆转MG源性VDBP结合神经元受体巨蛋白介导的下游SRC信号传导通路而实现。
那么,上述事件的发生在PrL区是否存在神经元亚型的选择性或特异性呢?MG源性VDBP过表达小鼠和对照组小鼠PrL区单细胞核测序分析显示,抑制性神经元细胞比例和差异表达基因数量增高,并富集于钙离子信号和突触活性等通路;离体脑片电生理测定和在体微型双光子成像分析结果一致性显示,敲除MG源性VDBP可逆转CUMS导致的PrL区抑制性神经元活性增强;免疫共聚焦分析进一步提示,MG衍生VDBP倾向结合抑制性神经元受体巨蛋白,为深入阐明PrL区MG源性VDBP介导的关键分子调控的抑制性神经元亚型及其下游投射参与抑郁发生的环路机制指明了方向,并提供了实证。
结论
综上所述,本研究深入阐明了小胶质细胞源性VDBP作为小胶质细胞-神经元交互作用的关键分子,通过结合神经元受体巨蛋白介导下游SRC信号传导通路,导致突触结构功能损伤,进而引发抑郁发生的分子机制,并可能偏向作用于抑制性神经元亚型而实现。这一发现为抑郁障碍的精准诊断和干预策略提供新思路和新方法。
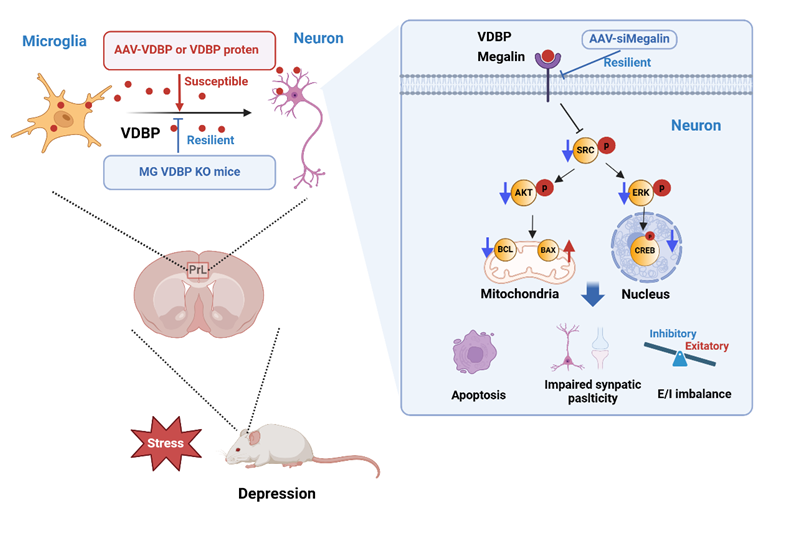
图3. MG源性VDBP结合神经元受体巨蛋白导致小鼠抑郁样行为发生机制示意图
专家点评
朱心红(教授,博导,广东省琶洲实验室,国家自然科学基金杰出青年科学基金获得者,2030科技创新-脑计划重大专项“抑郁障碍发病机制与干预研究”首席科学家)
抑郁症是最常见的心境障碍,病因不清,病理机制不明,个体化诊疗需求大,研究模式急需创新。东南大学张志珺/孔岩团队近期在《Advanced Science》发表的研究论文《Microglia-Derived Vitamin D Binding Protein Mediates Synaptic Damage and Induces Depression by Binding to the Neuronal Receptor Megalin》探讨了小胶质细胞(Microglia, MG)源性维生素D结合蛋白(VDBP)参与抑郁症发生的机制,为发现抑郁症诊断新生物标记和新治疗靶点提供了科学依据,也成功开启了临床和基础相结合的研究新范式。
VDBP是一种进化上保守的多功能血清α2-球蛋白,主要在肝实质细胞中合成,与巨蛋白(Megalin)结合后通过细胞内吞作用激活下游信号传导途径,发挥其生物学效应。张志珺/孔岩团队前期研究就发现VDBP在抑郁症患者的血浆和背外侧前额叶皮层中选择性增加(J Affect Dis, 2020),继而发现在血浆中小胶质细胞源性外泌体中选择性减少并提示血浆MG源性的VDBP可作为重度抑郁症的潜在生物标志物(Genes & Disease,2024)。为了进一步阐释MG源性VDBP参与抑郁症发生的机制,张志珺/孔岩研究团队制备了慢性不可预知温和应激(Chronic unpredictable mild stress, CUMS)小鼠抑郁模型,发现CUMS易感小鼠的前边缘皮层(Prelimbic cortex, PrL)VDBP高表达;选择性基因干预PrL的MG源性VDBP表达水平调节抑郁样行为。研究人员继续探讨了MG源性的VDBP对神经元和突触功能的影响,发现VDBP与神经元表面的Megalin结合后,显著降低了下游SRC和AKT等蛋白的磷酸化水平,介导神经元突触损伤和抑郁样行为。该研究揭示了小胶质细胞参与抑郁症发病的新机制,发现了新的血浆生物标记。进一步明确不同亚型抑郁症MG源性的VDBP的血浆水平以及药物反应性,有望提高抑郁症个体化诊疗水平。
罗雄剑(教授,博导,国家自然科学基金优秀青年科学基金获得者,东南大学生命健康高等研究院)
抑郁症严重威胁人类健康,给全球带来了巨大的社会经济负担。然而,目前我们对抑郁症的病因和发病机理知之甚少,使得我们难以对其进行精准有效的治疗和干预。
最近,东南大学附属中大医院张志珺教授和孔岩副教授团队联合中科院深圳先进技术研究院和深圳理工大学,在Advanced Science杂志发表了关于小胶质细胞源性维生素D结合蛋白(Vitamin D binding protein, VDBP)在抑郁发生中的作用及机制的重要研究成果。
张教授研究团队的前期研究提示脑源性VDBP在抑郁症发生中具有重要作用。在新的研究中,该团队进一步利用系列的现代神经科学研究手段和技术,深入解析了VDBP在抑郁症中的作用和机制。基于抑郁样行为动物模型的大脑表达谱数据显示,VDBP在抑郁小鼠大脑Prl区(是人类背外侧前额叶皮层的功能同源脑区)小胶质细胞中表达显著上调。为了进一步探索VDBP上调是否能导致小鼠产生抑郁样行为,作者在小鼠PrL脑区的小胶质细胞中特异过表达VDPB,发现VDBP过表达导致小鼠产生抑郁样行为。进一步的研究发现VDBP上调导致神经元活性降低、凋亡增加、突触蛋白减少和树突结构受损,提示VDBP可能通过影响神经元结构和功能介导抑郁行为。继而,团队成功建立了条件性小胶质细胞VDBP基因敲除小鼠,证实了其抵抗抑郁的作用。随后,作者进一步探索了VDBP如何通过介导小胶质细胞和神经元互作,从而导致神经元功能受损。作者发现,VDBP可直接结合神经元表面受体巨蛋白(Megalin),VDBP和Megalin结合抑制SRC非受体型酪氨酸激酶信号传导通路,导致神经元凋亡和突触受损。有趣的是,巨蛋白受体阻断剂RAP可逆转上述表型。最后,作者发现VDBP可能主要通过影响抑制性神经元导致抑郁表型。
综上,本研究有机结合临床和动物模型,利用系列的实验手段和技术,深入阐明了小胶质细胞源性VDBP通过结合神经元受体巨蛋白抑制下游SRC信号传导通路,导致突触结构功能受损,进而引发抑郁发生。该研究不仅揭示了脑源性VDBP在抑郁症中的重要作用和分子机理,而且为抑郁障碍的精准诊断和干预策略提供了新思路和方法。
董一言(浙江大学医学院博士后;本科毕业于北京大学,获医学学士;博士毕业于浙江大学,师从胡海岚教授,获神经生物学博士;主要从事抑郁症研究,以第一作者或通讯作者(含共同)发表研究论文Neuron (2024、2023a)、Nature(2018),发表学术评论Neuron(2023b、2019);主持国自然青年基金、“博新计划”、博士后面上项目等)
上世纪九十年代以来,临床一线应用的传统单胺类抗抑郁药以“起效慢、治愈率低”为核心的缺陷愈发显现,究其原因可能是未能靶向抑郁症的真正机制,为此,近三十年来研发快速的抗抑郁疗法和开发精准诊疗的生物标志物成为抑郁症研究领域两大主攻方向。近年研究表明,抑郁症存在多种亚型,对应的疗法有所不同。然而抑郁症临床诊断至今仍基于临床表象,长期缺乏客观的诊断标记。为此,精准鉴定抑郁症的生物标志物并进行亚型分型,将有助于减少治疗期间试错,实现“对症下药”,并阐明抑郁症发病机制。
张志珺教授带领的研究团队致力于抑郁症两大主攻领域,本次张教授团队发表于《Advanced Sciences》的研究,则是团队多年来深耕于抑郁症相关分子诊断生物标志物的新成果。本团队的前期研究发现,抑郁障碍患者血浆VDBP(Vitamin D binding protein,维生素D结合蛋白)水平特异性升高,与尸检脑组织中背外侧前额叶(dlPFC)VDBP蛋白选择性增高一致(J Affect Disord. 2020),基于基因表达数据库荟萃分析进一步发现抑郁障碍患者前额叶VDBP mRNA表达显著增高,因此,在这项新研究中张教授团队试图回答的关键的科学问题是:脑源性VDBP和抑郁症有什么联系?参与抑郁发生的具体机制又是什么?
团队通过全脑水平的筛选,发现抑郁易感小鼠的众多情绪相关脑区中仅有海马、内侧前额叶皮层PL亚区、下丘脑、伏隔核这4个区域出现VDBP的特异性升高,而VDBP水平在抑郁抗性小鼠中并未增加。基于前述发现,加之鼠脑的PL正是人脑dlPFC的功能同源区(Koob and Volkow, Lancet Psy. 2016),团队随即锚定PL脑区开展进一步研究,发现CUMS导致的VDBP增加只发生于小胶质细胞,并不发生于星形胶质细胞和神经元。这一细胞类型特异的VDBP基因和蛋白均表达增加,提示VDBP可能主要通过小胶质细胞调控小鼠抑郁样行为的发生。
为此,张教授团队在小鼠PL脑区的小胶质细胞中特异性地上调了VDBP的表达,发现增加VDBP水平足以在naïve小鼠中诱发多种抑郁样行为,并且能够进一步加重慢性压力诱导的抑郁表型。另一方面,在成年小鼠的小胶质细胞中特异性敲除VDBP能够逆转慢性压力导致的多种抑郁样行为。这些发现证实了VDBP与抑郁发病之间的因果关系。随后团队通过分子生化、细胞培养、免疫组化、电生理记录、在体微型双光子成像等多学科的前沿技术,进一步阐明了VDBP调控抑郁发病的神经机制:PL区域小胶质细胞表达的VDBP通过结合抑制性神经元中的巨蛋白,调控下游SRC信号通路,从而影响神经元活性和功能,诱导抑郁的发生。
总的来说,这项新研究在团队前期研究基础上进一步深化,以一系列扎实的证据揭示了VDBP通过小胶质细胞特异的方式调控抑郁发病,为开发小胶质细胞源性的VDBP分子标志物提供了关键的理论依据,推动了抑郁症的精准诊断。
本工作在张志珺教授和孔岩副教授指导下,一批研究生和研究助理均做出了贡献,尤其并列一作博士生李玲、张贤、赵特以及硕士生张艾妮和黄子涵做出了更为突出的贡献。该研究得到了2030-科技创新重大项目、国家自然科学基金重点和面上项目、深圳科技基金等项目资助。
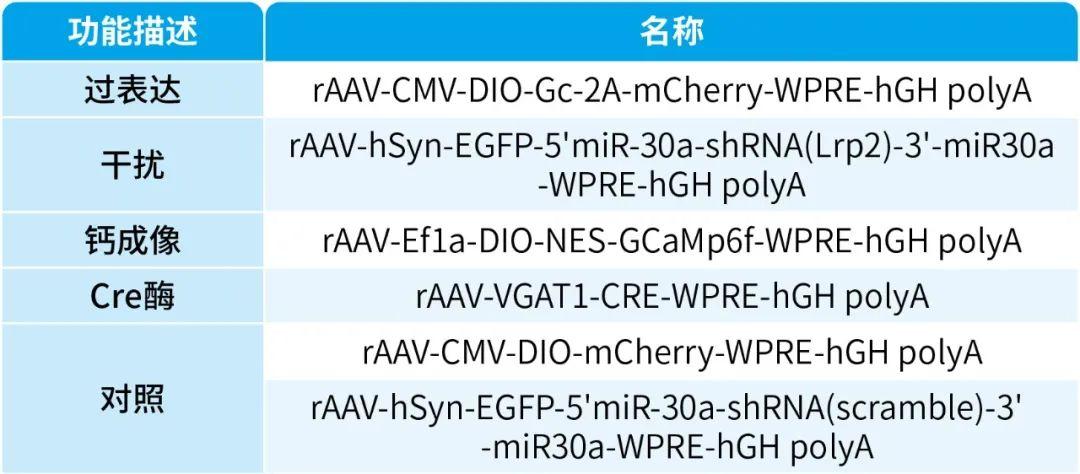
本文使用的病毒产品均来自枢密科技,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK