2023-12-04 阅读量:1419
对于癌症的治疗,单一的治疗方法(放疗、化疗、免疫疗法等)无法实现令人满意的治疗效果。多种疗法的结合是目前癌症治疗的主要趋势。近年来,重新激活T细胞的免疫检查点抑制剂疗法通过阻断免疫检查点通路实现抗肿瘤免疫,在治疗癌症方面取得了巨大的临床成功。一系列靶向免疫检查点的抑制剂,如细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、程序性细胞死亡蛋白1(PD-1)和PD-1配体1(PD-L1)已被开发。然而,研究表明,超过三分之二的患者对免疫检查点阻断(ICB)治疗有耐药性,ICB治疗的低应答率主要是由肿瘤组织中的免疫抑制环境引起的。此外,ICB治疗需要多个全身剂量,导致患者依从性差和全身不良反应。开发新的联合免疫疗法协同增强免疫激活和缓解免疫抑制成为一个重要的挑战。
第10号染色体上磷酸酶和张力蛋白同源等位基因(PTEN),是一种被广泛研究的肿瘤抑制因子,多种癌症中均观察到PTEN基因的缺失。最近的临床研究表明癌细胞中PTEN的缺失突变可能与免疫抑制肿瘤微环境(TME)和ICB疗法疗效不佳有关。PTEN基因表达缺陷是肿瘤组织中免疫细胞浸润减少与抗PD-1治疗耐药性提高的重要原因。进一步的机制研究显示PTEN可以诱导肿瘤细胞自噬来抑制肿瘤发生。因此,有效恢复癌细胞中PTEN基因的表达对于提高ICB治疗的应答率至关重要。
基于以上发现,研究人员推测肿瘤细胞中恢复PTEN基因表达,应提高ICB治疗效果,这两种疗法可能具有协同抗肿瘤作用。对于PTEN治疗来说,安全有效地将PTEN基因在体递送到肿瘤细胞是至关重要的。因为腺相关病毒(AAV)的基因递送效率高、免疫原性低、安全性高,其是将PTEN基因递送至肿瘤细胞的理想载体。AAV在临床上已被用于各种疾病的基因治疗。此外,研究表明AAV具有强大的肿瘤穿透力,因此有可能有效地将PTEN基因递送到肿瘤中。肿瘤复发已成为恶性肿瘤治疗失败的主要原因。对于肿瘤复发,如何有效激活免疫系统,诱导肿瘤特异性免疫记忆是非常重要的。肿瘤疫苗是通过诱导肿瘤特异性细胞免疫和体液免疫来根除肿瘤的理想方法。CpG(寡聚脱氧核苷酸,ODN)是Th1细胞的免疫佐剂,也是TLR9(Toll Like Receptor 9,Toll样受体9)激动剂,具有强大的免疫刺激佐剂活性。
2023年6月13日,四川大学华西药学院孙逊教授团队在Acta Pharmaceutica Sinica B期刊在线发表题为“Combination of AAV-delivered tumor suppressor PTEN with anti-PD-1 loaded depot gel for enhanced antitumor immunity”的研究论文,本文中,作者筛选了一种AAV衣壳,用于将PTEN基因有效递送到小鼠皮肤黑色素瘤细胞(B16F10,肿瘤细胞)中。瘤内注射AAV6-PTEN成功地恢复了肿瘤细胞PTEN基因的表达,并通过诱导肿瘤细胞免疫原性细胞死亡(ICD)和增加免疫细胞浸润来有效抑制肿瘤进展。此外,研究人员开发了一种负载抗PD-1的磷脂基相分离凝胶(PPSG),该凝胶在小鼠体内42天内形成原位储库并可持续释放抗PD-1药物。为有效抑制黑色素瘤的复发,进一步应用基于AAV6-PTEN、PPSG@anti-PD-1和CpG的三联疗法,结果表明这种三联治疗策略增强了协同抗肿瘤免疫效果,还诱导了强大免疫记忆,从而完全抑制了肿瘤复发。总的来说,这种三联疗法可以作为一种新的肿瘤联合疗法,具有更强的免疫激活能力和肿瘤抑制效果。

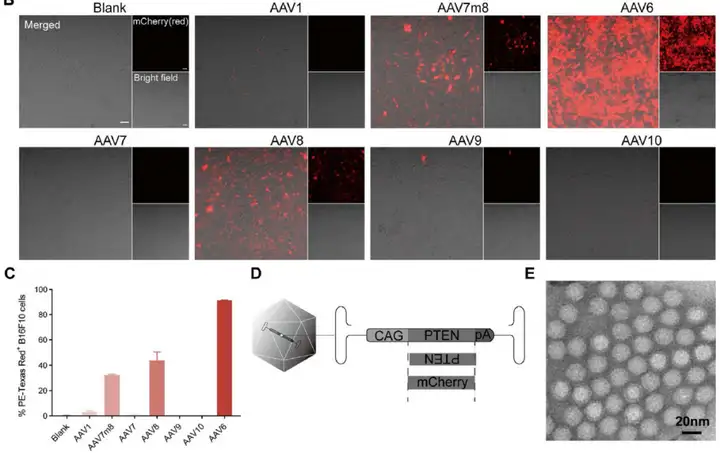
1. 高效递送PTEN基因到B16F10细胞的AAV衣壳蛋白的筛选
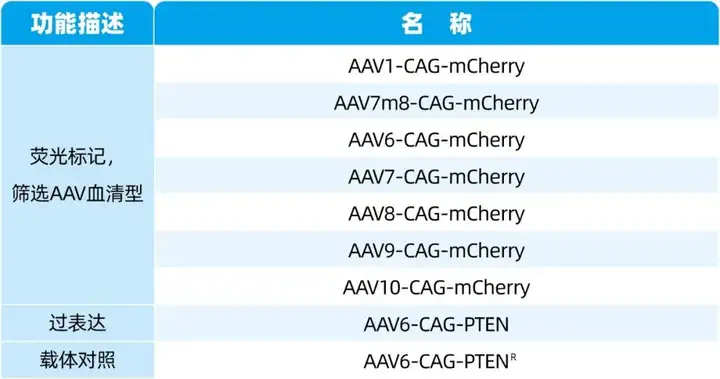
为有效将PTEN基因递送到B16F10细胞中,研究人员筛选AAV的血清型。利用哺乳动物细胞中高表达的CAG启动子调控靶基因mCherry表达,载体为AAV-CAG-mCherry,血清型为AAV1、AAV7m8、AAV6、AAV7、AAV8、AAV9和AAV10。接下来,探究不同血清型的AAV-mCherry感染B16F10的效率,AAV-mCherry以MOI=1×105感染B16F10细胞48小时,mCherry的表达通过荧光确定(共聚焦显微镜成像),随后收集细胞用于流式细胞术分析。结果显示,AAV6可感染91%以上的B16F10细胞,而AAV7m8和AAV8可以感染不超过44%的B16F10细胞。AAV的其他血清型感染B16F10细胞的效率较低。因此,作者选择了血清型6,以有效地递送PTEN基因,包装和纯化AAV6-CAG-PTEN(以下简称AAV-PTEN),并翻转PTEN基因序列和包装AAV6-CAG-PTENR(以下简称AAV-PTENR)作为载体对照。
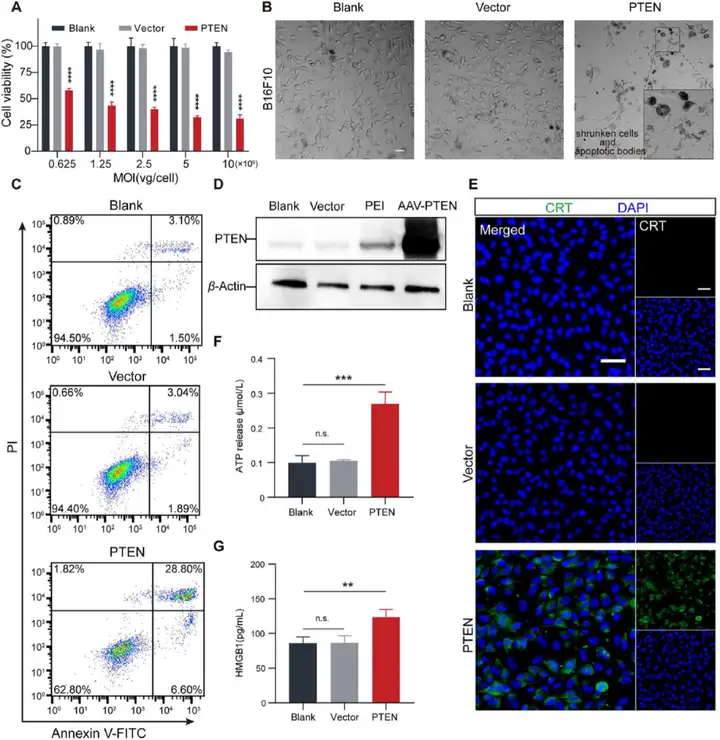
2. AAV6-PTEN恢复PTEN表达诱导细胞凋亡和免疫原性细胞死亡
既往研究显示,人癌症细胞中恢复PTEN基因表达可抑制肿瘤生长。研究人员将AAV-PTEN以MOI=1×105感染B16F10细胞48小时,PBS是空白组(Blank)、AAV-PTENR是载体组(Vector),转染试剂PEI和空载的混合物是PEI组,Western blot证实AAV-PTEN有效恢复B16F10细胞中PTEN的表达。随后利用AAV-PTEN以不同MOI感染B16F10细胞48小时,测定细胞活力,结果显示即使在高MOI(1×106)下,AAV-PTENR对B16F10细胞的毒性也可以忽略不计。然而AAV-PTEN组检测到更多的死细胞,IC50为MOI=9.7×104。显微镜下观察B16F10细胞形态,结果显示明显的凋亡现象:细胞萎缩和凋亡小体出现在细胞周围。利用流式细胞术测定细胞凋亡(FITC/PI双染法),结果显示AAV-PTENR组细胞凋亡率没有增加,表明AAV载体没有诱导B16F10细胞凋亡。然而,AAV6-PTEN组显著增加了晚期凋亡细胞。与对照组相比,AAV6-PTEN组凋亡细胞的比例增加了约7倍。表明AAV-PTEN有效促进B16F10细胞的凋亡。前人研究证明PTEN的激活可以促进损伤相关分子模式(DAMPs)的释放并触发免疫原性细胞死亡。表征ICD的三个标志性事件:细胞膜上钙网蛋白CRT的表达;高迁移率族蛋白B1HMGB1和三磷酸腺苷ATP释放到胞外环境。于是,研究人员测定AAV-PTEN处理后B16F10细胞膜上CRT的表达(免疫荧光成像);ELISA检测AAV-PTEN处理后B16F10细胞培养上清液中HMGB1和ATP含量。结果显示,AAV-PTEN组细胞膜上CRT表达显著增加;HMGB1和ATP释放明显增多。综上所述,这些结果表明,AAV6-PTEN诱导细胞凋亡,同时触发ICD。
图2. AAV6-PTEN处理诱导细胞凋亡和免疫原性细胞死亡
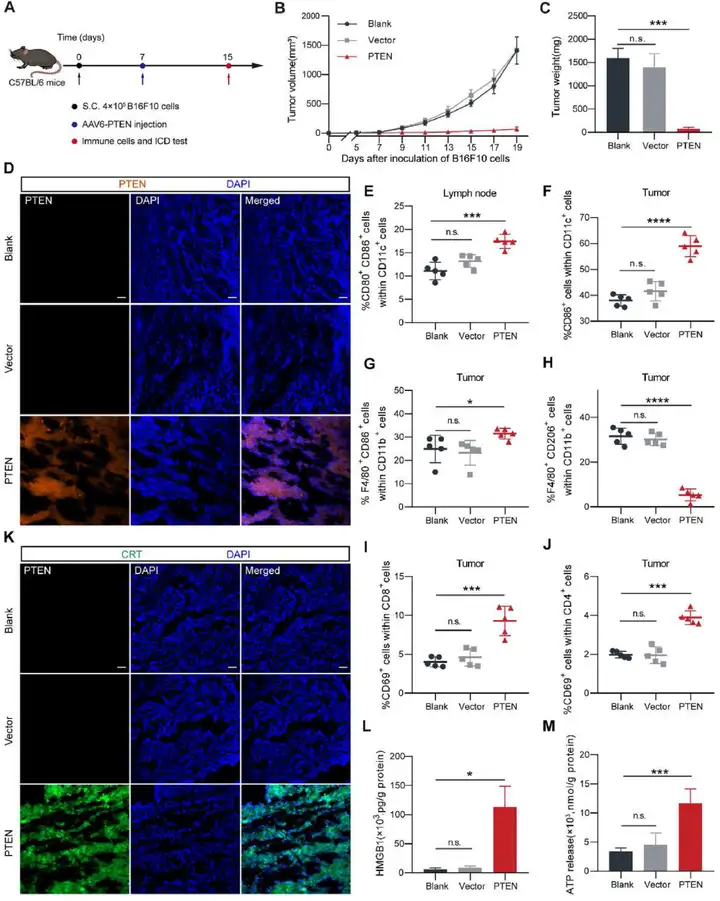
3. AAV-PTEN在小鼠体内诱导抗肿瘤免疫反应
研究人员进一步进行体内实验探究AAV-PTEN能否诱导肿瘤细胞凋亡并激活抗肿瘤免疫反应。选择C57BL/6小鼠构建皮下B16F10肿瘤模型,首先确认AAV-PTEN是否可以恢复B16F10荷瘤小鼠中PTEN基因的表达,B16F10荷瘤小鼠分别瘤内注射PBS、AAV-PTENR或AAV-PTEN,96小时后免疫荧光证实肿瘤组织中PTEN的表达。结果显示注射AAV-PTEN小鼠肿瘤组织中高表达PTEN基因。
然后,作者利用B16F10荷瘤小鼠模型在体评估AAV-PTEN的抗肿瘤免疫反应。首先,将含4×105个B16F10细胞的50 μL PBS皮下植入小鼠的右背部,以建立B16F10皮下肿瘤。当平均肿瘤体积达到30 mm3,将B16F10荷瘤小鼠随机分为三组,瘤内注射PBS(每只小鼠5 μL作为Blank/空白组)、AAV-PTENR(Vector组,每只小鼠5 μL PBS中含病毒基因组拷贝数为1.5×1010v.g.)或AAV-PTEN(每只小鼠5 μL PBS中含病毒基因组拷贝数为1.5×1010v.g.)。每两天测量一次肿瘤体积和重量。Day 15小鼠被安乐一死,采集腋窝淋巴结和肿瘤,以评估免疫细胞的表型和数量以及ICD。结果显示依据肿瘤生长曲线和肿瘤重量(Day 14),AAV-PTEN显示出强大的抑制肿瘤生长的能力。成熟树突状细胞DCs被认为向T细胞呈递抗原,因此对抗肿瘤免疫反应很重要。于是,分析AAV-PTEN处理后肿瘤引流淋巴结(TDLNs)固有DCs的成熟情况。结果表明淋巴结固有DCs(LNDCs)上各种DCs成熟标志物(CD80、CD86等)的表达在AAV-PTEN处理后上调。此外,流式细胞术分析显示成熟DCs(CD11c+CD86+)和M1型巨噬细胞比例(CD11b+F4/80+CD86+)在肿瘤中也增加。相反,M2型巨噬细胞(CD11b+F4/80+CD206+)大大减少。与Blank组相比,肿瘤中活化的CD8+效应T细胞(CD3+CD8+CD69+)和活化的CD4+辅助T细胞(CD3+CD4+CD69+)比例上调。上述结果表明,AAV6-PTEN处理增加了肿瘤免疫细胞浸润并逆转肿瘤免疫抑制性微环境。下一步通过ELISA和免疫荧光测试ICD的形成。利用ELISA检测肿瘤组织中HMGB1和ATP释放,结果显示小鼠经AAV-PTEN处理后HMGB1和ATP释放明显增多。同时,免疫荧光染色结果也显示AAV-PTEN处理小鼠的肿瘤组织中钙网蛋白CRT高表达。总的来说,这些结果表明,通过AAV-PTEN恢复PTEN表达在小鼠体内有效诱导ICD。
图3. AAV6-PTEN在体诱导抗肿瘤免疫反应
4. PPSG@Cy5-anti-PD-1缓释anti-PD-1
研究人员开发负载抗PD-1的磷脂基相分离凝胶(PPSG),为检测PPSG在小鼠体内的持续释放作用,作者在C57BL/6小鼠皮下注射游离Cy5-anti-PD-1(Cy5标记的抗PD-1,红色)或PPSG@Cy5-anti-PD-1。然后从注射后1小时至42天的不同时间点对小鼠进行活体成像,观察PPSG释放的Cy5-anti-PD-1。结果显示注射游离Cy5-anti-PD-1的小鼠中,荧光衰减得很快,到第七天几乎消失了。而注射PPSG@Cy5-anti-PD-1小鼠中,荧光衰减缓慢,在Day 42(第42天)仍然可检测到。上述结果表明PPSG@Cy5-anti-PD-1具有良好的缓释效果,通过在小鼠皮下形成药物贮库可持续释放anti-PD-1。PPSG优异的缓释效果可以大大降低给药频率,在保证药物疗效的前提下提高患者对治疗方案的依从性。
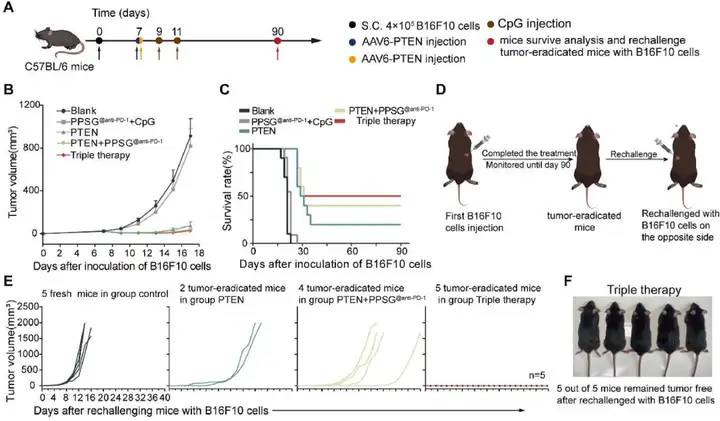
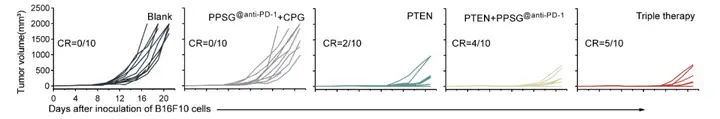
5. AAV-PTEN+PPSG@anti-PD-1 + CpG的三联疗法在皮下B16F10荷瘤小鼠模型中增强抗肿瘤作用并诱导免疫记忆
作者在C57BL/6小鼠右背部皮下接种含4×105个B16F10细胞的50 μL PBS获得B16F10荷瘤小鼠,B16F10荷瘤小鼠随机分为5组(每组10只):空白组,PPSG@anti-PD-1+CpG组,PTEN组,PTEN+PPSG@anti-PD-1组和PTEN+PPSG@anti-PD-1+CpG(以下简称三联疗法)组。肿瘤细胞植入后第7天,空白组瘤内注射PBS(每只小鼠5 μL);瘤内注射AAV-PTEN(每只小鼠5 μL PBS中含病毒基因组拷贝数为1.5×1010v.g.);肿瘤周围皮下注射PPSG@anti-PD-1(每只小鼠100 μL PPSG中含100 μg anti-PD-1)。第9天和第11天,小鼠右前臂皮下注射CpG(每只小鼠25 μL生理盐水中含3 μg)。处理后,每两天测量一次肿瘤体积,每天监测一次小鼠存活率。结果显示,与空白组相比,PPSG@anti-PD-1+CpG组对肿瘤的抑制作用较弱,这可能与B16F10细胞PTEN缺陷引起ICB治疗的耐药、不能产生ICD以释放抗原有关。第14天,三个AAV6-PTEN处理组中50%的小鼠肿瘤(即每组分别有5只小鼠的肿瘤消失了)。后来,PTEN组与PTEN+PPSG@anti-PD-1组的一些小鼠开始有肿瘤复发,但PTEN+PPSG@anti-PD-1+CpG的三联疗法组并不会出现肿瘤复发。肿瘤细胞接种后第90天(Day 90),PTEN单独处理组10只小鼠中仅2只有效抑制肿瘤生长并根除肿瘤(有3只小鼠肿瘤复发了,存活率为20%)。与PTEN组相比,PTEN+PPSG@anti-PD-1组进一步抑制肿瘤生长并提高荷瘤小鼠的存活率,10只小鼠中有4只根除了肿瘤(有1只小鼠肿瘤复发了,存活率为40%)。三联治疗组获得了最高的小鼠存活率,10只小鼠中有5只根除了肿瘤(无肿瘤复发,存活率为50%)。
研究人员继续探讨三联疗法是否能诱导B16F10荷瘤小鼠的免疫记忆。在第90天,三组肿瘤根除小鼠(PTEN组2只,PTEN+PPSG@anti-PD-1组4只,三联治疗组5只)左背部皮下注射含4×105个B16F10细胞的50 μL PBS,第0天对照组5只新C57BL/6小鼠也皮下植入相同数量的B16F10细胞。每两天测量一次肿瘤体积。对照组肿瘤生长迅速,小鼠在第16天全部死亡。PTEN组和PTEN+PPSG@anti-PD-1组延缓肿瘤复发及肿瘤生长缓慢,但最终所有小鼠都死亡了。然而,三联治疗组的5只肿瘤根除小鼠全部在再次注射B16F10细胞后仍然无肿瘤。
最后,研究人员对三联疗法诱导抗肿瘤免疫反应和避免肿瘤复发的机制进行探究,证明三联疗法更好地逆转免疫抑制肿瘤微环境,从而诱导更强的抗肿瘤免疫应答;三联疗法通过增加脾脏记忆T细胞、血清中特异性抗体的分泌及促进淋巴结DCs的成熟获得免疫记忆,从而抑制肿瘤复发。
图4. 三联疗法在皮下B16F10荷瘤小鼠模型中的协同治疗作用
结论
PTEN+PPSG@anti-PD-1+CpG的三联疗法具有协同抗肿瘤免疫效果,引发强大的抗肿瘤免疫作用,在根除恶性肿瘤和抑制肿瘤复发方面前景广阔。
通讯作者介绍
孙逊,博士,博士生导师,四川大学华西药学院教授,药剂学系主任。国家杰出青年科学基金获得者,国家药典委员会委员,国家优秀青年基金获得者,英国皇家学会牛顿高级学者,四川省学术和技术带头人,四川省高级留学回国人员。主持国家自然科学基金9项,国际合作项目3项,教育部新世纪优秀人才计划1项,国家科技重大专项子课题1项,四川省重大科技专项1项。研究方向:1. 生物大分子药物高效递释系统;2. 靶向药物传递系统和分子药剂学

本文使用的病毒产品,列表如下:

了解产品及服务
请扫码或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK