2022-03-25 阅读量:1845
一、原理
腺相关病毒(Adeno-associated Virus,AAV)属于细小病毒科(parvoviridae),病毒颗粒无包膜,结构为直径约20nm的正二十面体,是迄今发现的一类结构最简单且无法自主复制的线性单链DNA病毒,对分裂细胞和非分裂细胞均具有感染力。通过人工进化的方法对AAV衣壳蛋白Cap基因进行定向突变改造,可以筛选到具有高转导效率和不同感染特性的AAV载体,极大增加了AAV的应用潜力。
研究中采用的重组腺相关病毒(Recombination adeno-associated virus,rAAV)载体是在非致病的野生型AAV的基础上改造的基因表达载体,具有种类多样、免疫原性低、安全性高、宿主范围广、扩散能力强、体内表达外源基因时间长等特点,已被广泛的应用在动物水平的基因表达、基因操作和基因治疗。
rAAV所包含的DNA一般是用外源基因表达元件替换AAV的编码基因,仅保留了病毒复制和包装所需的ITR序列。通过反式补偿Rep基因、Cap基因和辅助病毒功能因子包装产生携带外源DNA的rAAV。AAV的总包装容量是4.7kb,目的基因长度要求不超过3.5kb。
眼睛个体小、相对封闭、具备免疫赦免,是基因治疗中非常热门的器官。随着视网膜和视皮层遗传性疾病分子机制研究的不断深入,基因治疗某些遗传性眼部疾病(如视网膜色素变性、Leber先天性黑朦等),病理性眼部疾病(如缺血性视网膜病变、视神经病变、缺血性脉络膜病变等)或其他眼部疾病(视神经损伤)已成为可能。AAV是在体实验的优先选择。2型、5型、8型、9型等对眼部的趋向性较高。优先考虑CBA/CMV/CAG启动子。
二、注射方法
病毒载体介导的眼部基因传递途径依治疗目的不同主要有玻璃体腔注射、视网膜下腔注射、前房注射、结膜下注射、角膜下注射等。比较常用的是玻璃体腔注射和视网膜下腔注射。研究表明,在多种动物模型中,AAV载体玻璃体腔注射主要感染神经节细胞和Mǜller细胞,此种注射方法会产生针对AAV衣壳蛋白的体液免疫反应,这种反应可阻碍再次注射时AAV的表达,因此,如果两只眼都需要连续治疗的话,需要避免使用这种注射方式。视网膜下腔注射主要感染视网膜色素上皮细胞和光感受器细胞,不会触发体液免疫反应,对另一只眼再次视网膜下腔注射也无影响,说明视网膜下腔对眼球的免疫赦免特性起着重要作用。
三、应用
基因功能研究
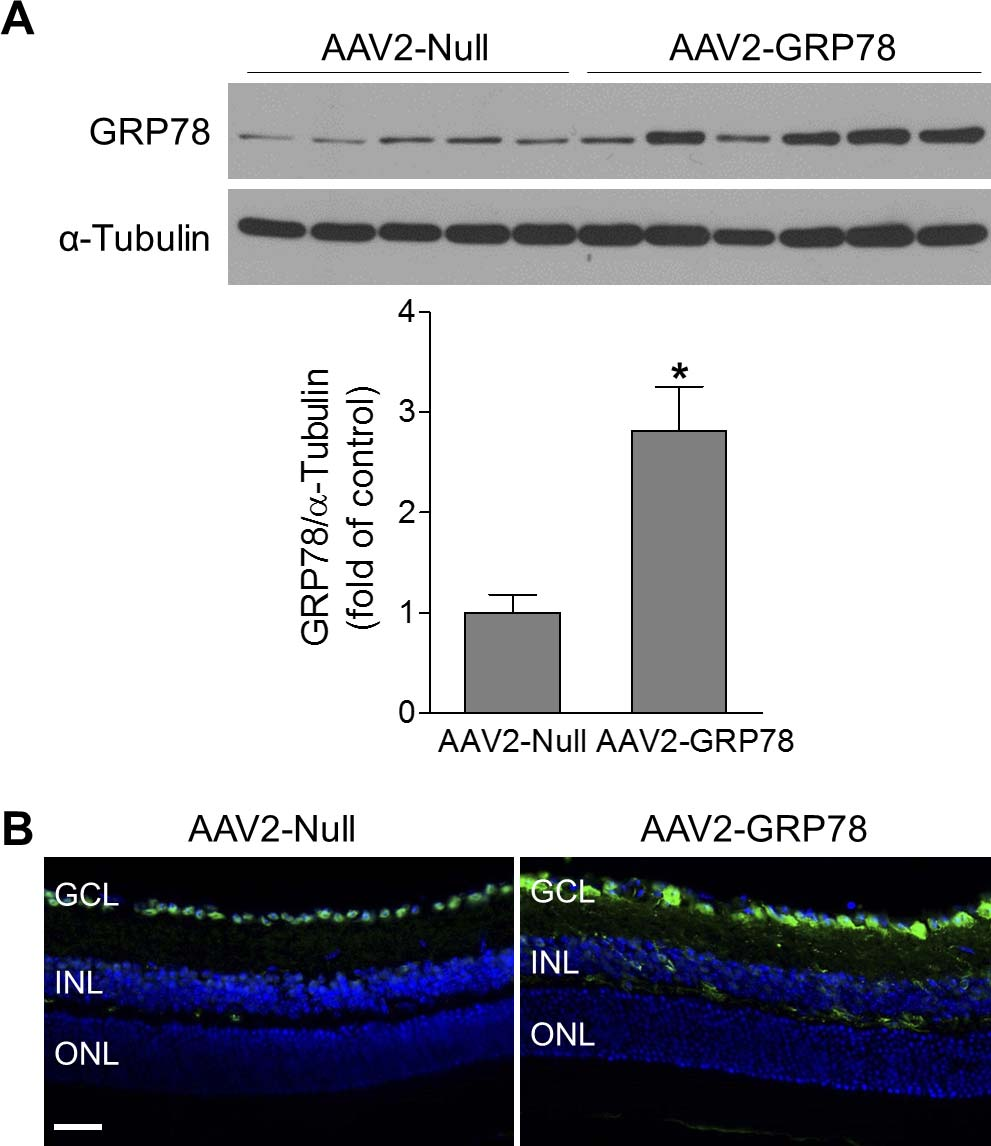
4周龄C57BL/6J小鼠玻璃体腔注射1μL AAV2-CAG-hGRP78、AAV2-Null control(1×1012 vector genomes[VG]/mL),4周后western blotting评估GRP78的表达,结果显示AAV2-GRP78小鼠视网膜中GRP78蛋白水平显著升高。免疫染色进一步分析GRP78在视网膜中的分布,结果表明GRP78主要定位于GCL(神经节细胞层)的神经元中。即证明AAV2介导GRP78在RGC(视网膜神经节细胞)中高效特异表达。
GRP78过表达可减轻TON后RGC死亡
在玻璃体腔注射AAV2-Null或AAV2-GRP78,4至5周后进行TON(外伤性视神经病变),TON3天后收集视网膜。对视网膜冰冻切片进行TUNEL(原位末端凋亡检测)分析。绿色荧光反映TUNEL阳性细胞,蓝色荧光为细胞核DAPI染色,结果表示AAV2-GRP78-TON组RGC凋亡细胞数量明显少于AAV2-Null-TON组。

GRP78的过表达可防止TON后RGCs的细胞/功能丧失
在玻璃体腔注射后4至5周进行TON,在TON后7天,用Tuj-1抗体(绿色)标记RGC。结果表示AAV2-Null-TON组RGC数量在TON后减少59%,AAV2-GRP78-TON组RGC数量显著多于AAV2-Null-TON组,即表明GRP78过表达能部分阻止RGC减少。TON后AAV2-Null感染视网膜中pSTR(正暗视阈值反应)响应不同闪光强度的振幅明显降低,表明RGC功能障碍。然而,这种pSTR振幅的降低在感染AAV2-GRP78的视网膜中明显更少。即表示RGC功能损失更轻。
参考文献:
Ha Y, Liu W, Liu H, et al. Invest Ophthalmol Vis Sci. 2018.
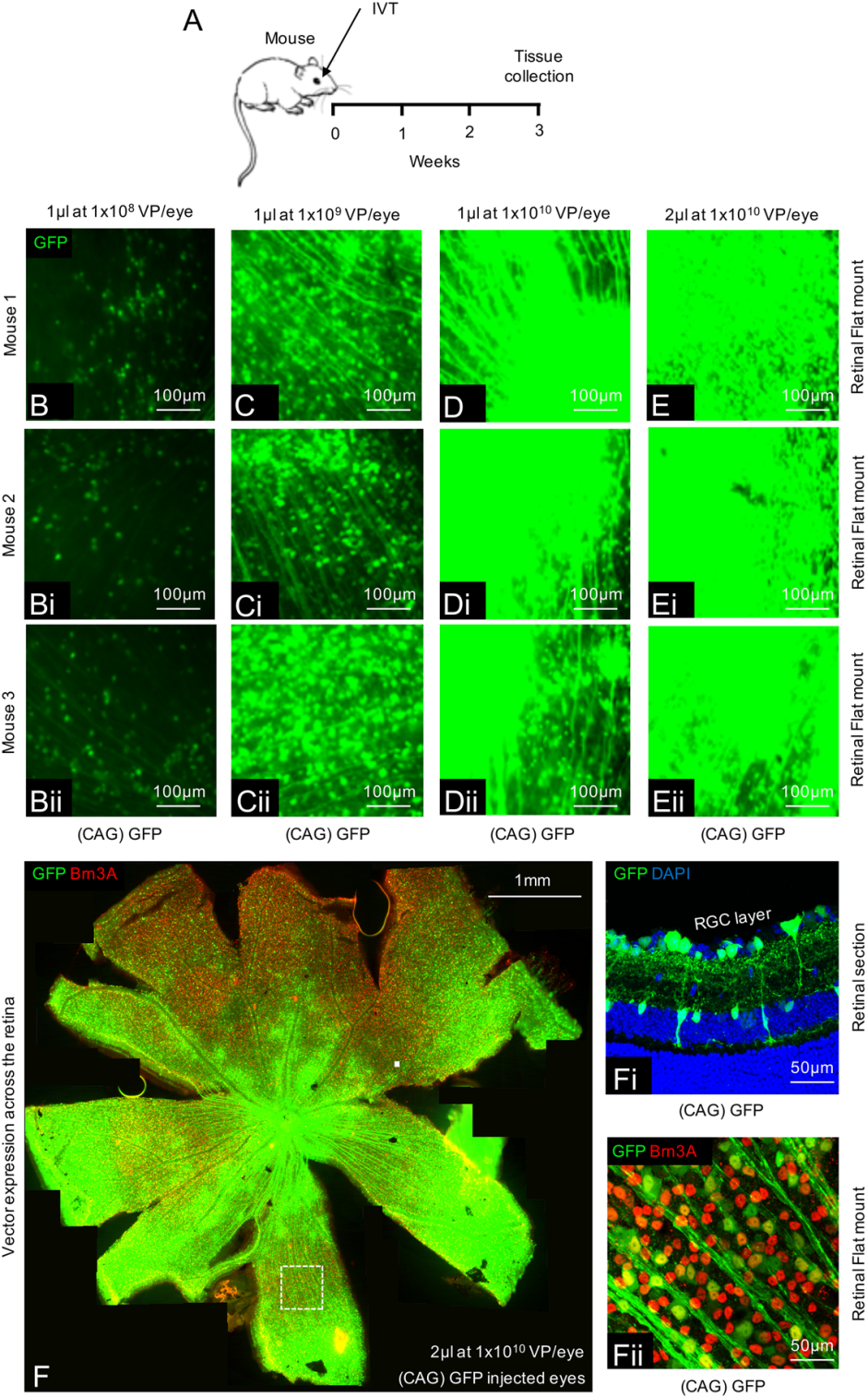
使用AAV2-CAG载体系统能确保在小鼠视网膜中充分转染
不同滴度和体积的AAV2-CAG-GFP通过巩膜注入成年雄性C57BL/6小鼠眼睛的玻璃体(颞上缘后方约3mm处),3周后检测整个视网膜中GFP表达。结果显示2μL,1×1010VP(Virus Particle)/眼表达效果最好。2μL,1×1010VP/眼处理小鼠视网膜平铺扫描结果表示病毒载体主要转导视网膜内的视网膜神经节细胞(RGC)和一些无长突/Müller胶质细胞。GFP与大部分Brn3A标记RGC共定位。表明感染大部分视网膜神经节细胞。
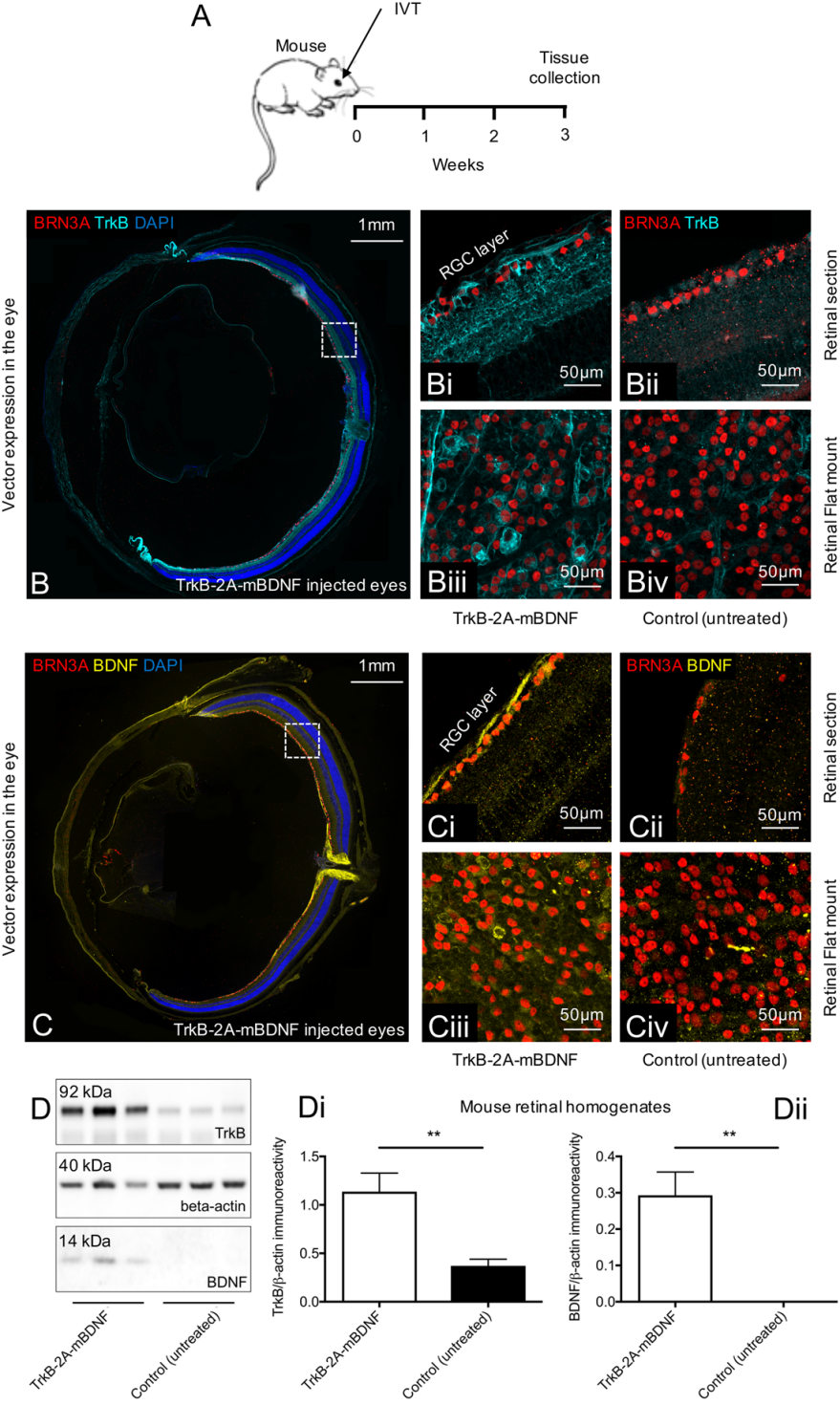
玻璃体腔递送AAV2-TrkB-2A-mBDNF(2µL,9.14×109VP/眼)3周后小鼠眼睛中TrkB和BDNF的表达
与未经治疗的眼睛相比,AAV2-TrkB-2A-mBDNF治疗后小鼠整个视网膜中转导的RGC(Brn3A阳性细胞)细胞表面的TrkB受体表达增加,转导的RGC内BDNF的表达上调。与对侧未经治疗的眼睛相比,AAV2-TrkB-2A-mBDNF递送后的视网膜裂解物中TrkB和BDNF的表达都升高。
参考文献:
Osborne A, Khatib TZ, Songra L, et al. Cell Death Dis. 2018.

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK