2022-10-31 阅读量:832
在瞬息万变的自然环境中,动物需要根据自己所处的环境与状态灵活地提取记忆。然而,日常情绪如何快速且直接地影响记忆痕迹(memory engram)的提取效率目前还缺乏相关神经机制的阐释。记忆被认为存储在一群被称为痕迹细胞(engram cell)的神经元集合中,且存在多种状态,如沉默态(不可提取)、潜伏态(可以提取)和活跃态(正在提取)。在病理或人工条件下,记忆可以形成沉默的痕迹,无法通过呈现条件刺激进行提取,在沉默状态下,只有人为激活痕迹细胞才能诱导记忆表达,从而允许自然回忆。而潜伏的痕迹细胞可以通过自然条件刺激激活,使其变为活跃状态以进行记忆提取。然而,记忆痕迹的不同状态,尤其是沉默状态的生理学意义仍不清楚。
2022年4月4日,清华大学生命科学学院钟毅教授课题组在《美国国家科学院院刊》(PNAS)杂志发表题为“Social experiences switch states of memory engrams through regulating hippocampal Rac1 activity”研究论文。本文中,作者研究表明社交奖励将沉默记忆痕迹转化为潜伏状态。相反,社交压力将潜伏的记忆痕迹转变为沉默状态,进而导致短暂的遗忘。这种情绪驱动的记忆痕迹的潜伏和沉默状态之间的双向转换由海马Rac1活性依赖的可逆性遗忘的调控所介导。压力激活的Rac1抑制记忆提取,而奖赏通过抑制Rac1来恢复失忆状态下沉默的记忆。总的来说,上述数据表明海马Rac1活性是情绪介导的潜伏和沉默记忆痕迹转换以实现情绪驱动的行为灵活性的基础。

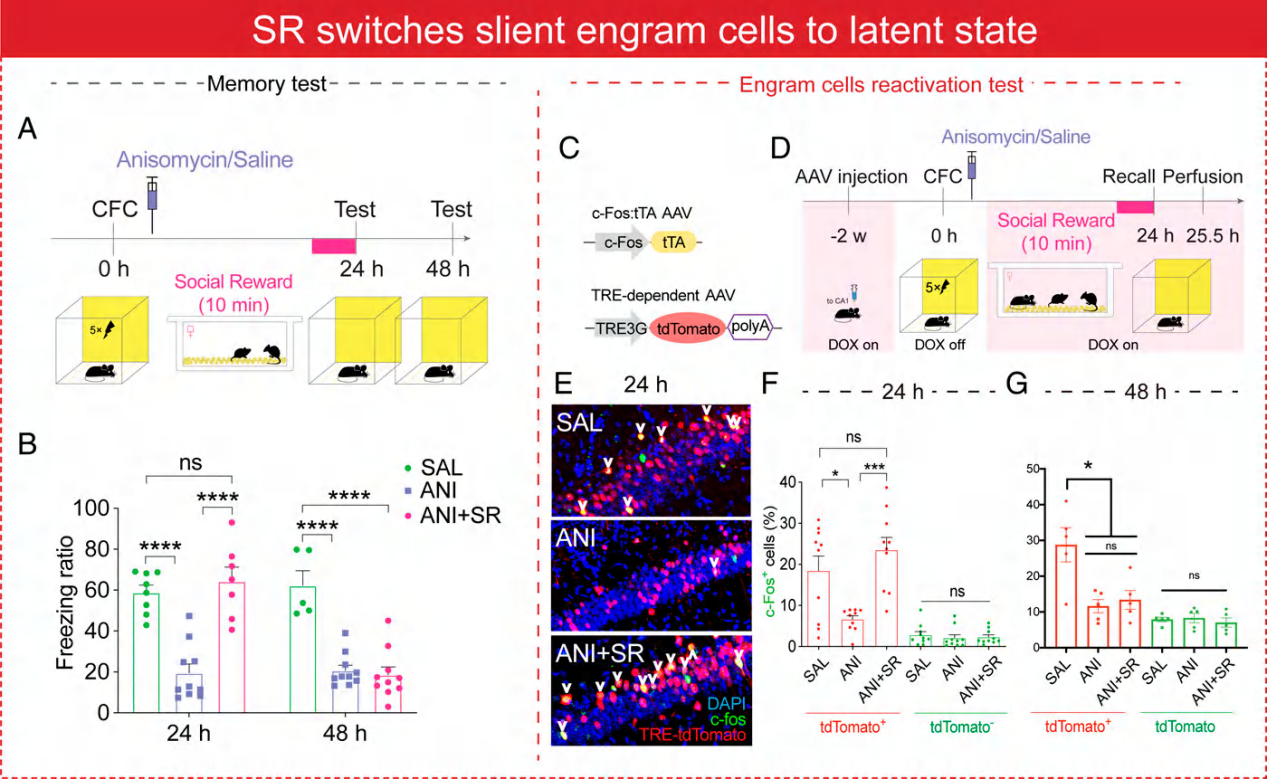
1.社交奖励将记忆痕迹从静默状态转变到潜伏状态
将一只实验雄性小鼠与不同窝的两只异性小鼠相处作为社交奖励(SR),一只实验雄性小鼠与五只同窝雄性小鼠相处作为社交压力(SS)。在条件性恐惧(关联性条件化恐惧,CFC)训练后立即注射蛋白质合成抑制剂茴香霉素(ANI),使记忆痕迹细胞进入静默状态,抑制恐惧记忆的形成。但小鼠在记忆检测前,若给予社交奖励,则可增强小鼠的恐惧记忆水平。
使用病毒手段标记记忆痕迹细胞,发现ANI明显降低海马脑区记忆痕迹细胞的数量,而社交奖励处理则可恢复记忆痕迹细胞的数量。说明社交奖励可将静默状态的记忆痕迹转变为潜伏状态。
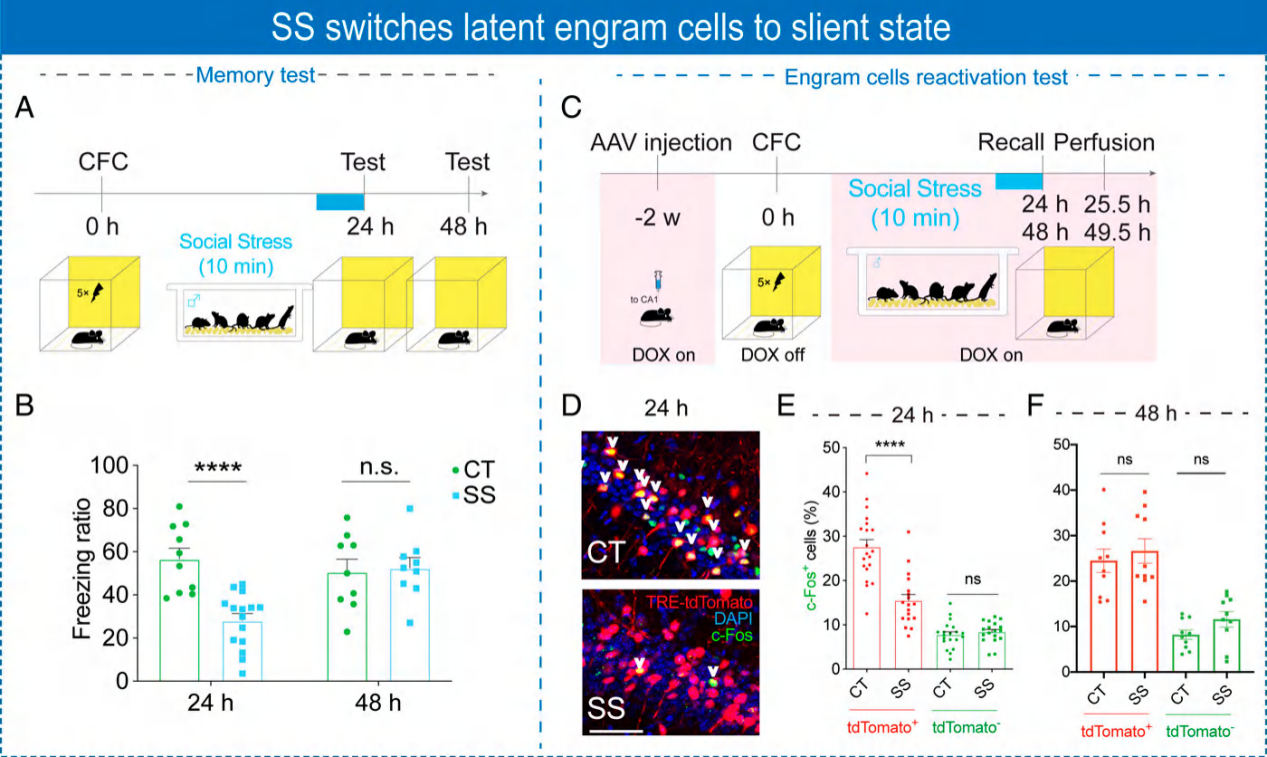
2.社交压力促进记忆痕迹从潜伏状态转变到静默状态
在条件性恐惧训练完成后,在记忆检测前让小鼠经历社交压力,发现经历社交压力能明显降低小鼠僵直率,说明记忆痕迹有可能从潜伏状态进入了静默状态。对小鼠海马脑区的记忆痕迹细胞进行标记,发现条件恐惧训练后,小鼠记忆痕迹细胞的数量显著增加,但是给予社交压力处理后,能降低激活的记忆痕迹细胞的数量。
图2. 社交压力促进记忆痕迹从潜伏状态转变到静默状态
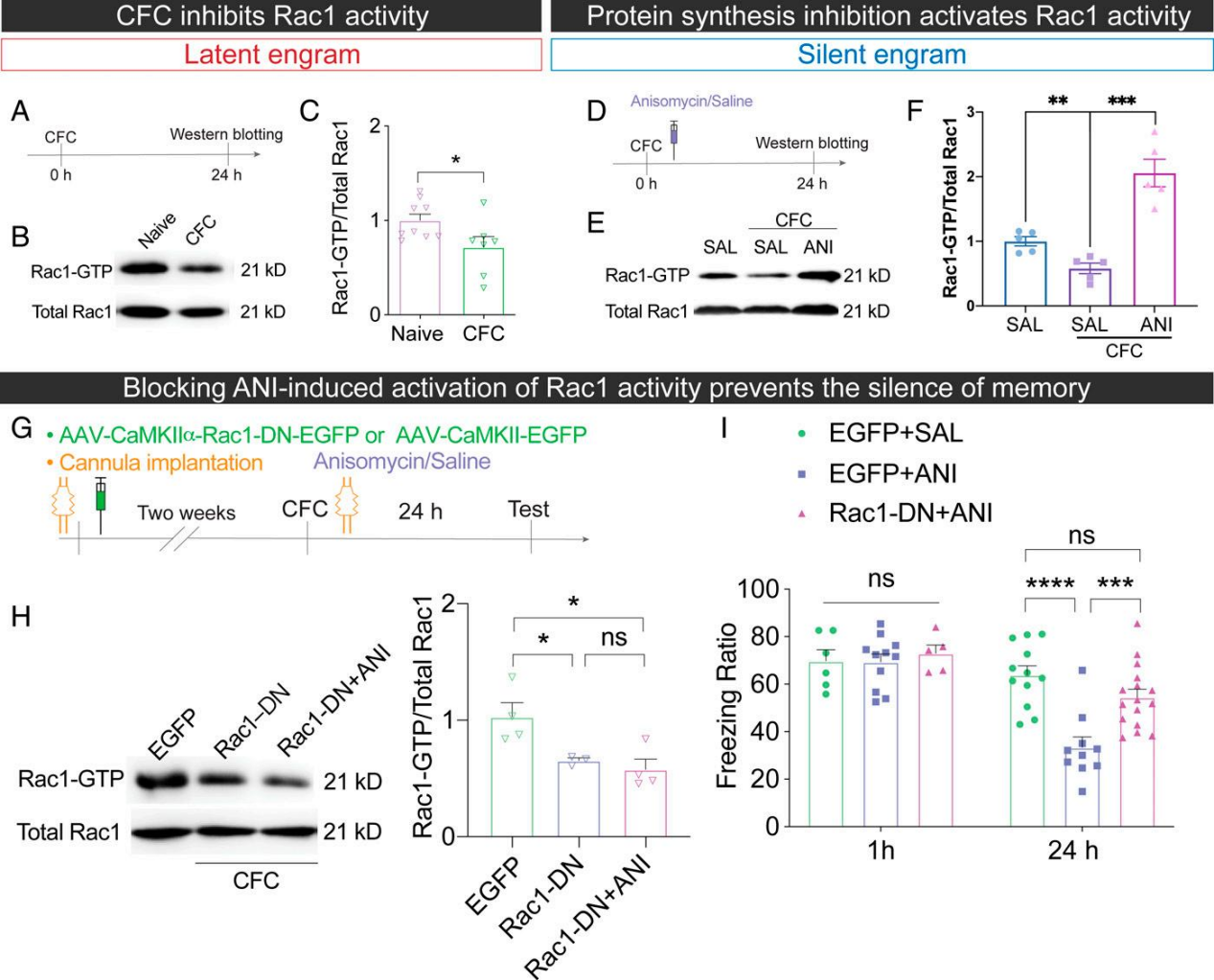
3.海马脑区Rac1的活性调节记忆痕迹的状态
对记忆痕迹状态转换的分子机制进行研究,发现条件恐惧诱导潜伏状态记忆痕迹形成时,海马脑区的Rac1活性明显降低,而注射ANI诱导静默痕迹形成时,海马脑区活性Rac1活性明显增加。为了确认Rac1和记忆痕迹之间的调节关系,研究人员注射AAV病毒靶向诱导海马脑区兴奋性神经元Rac1活性降低,发现Rac1活性降低确实能恢复ANI损伤的条件恐惧记忆。
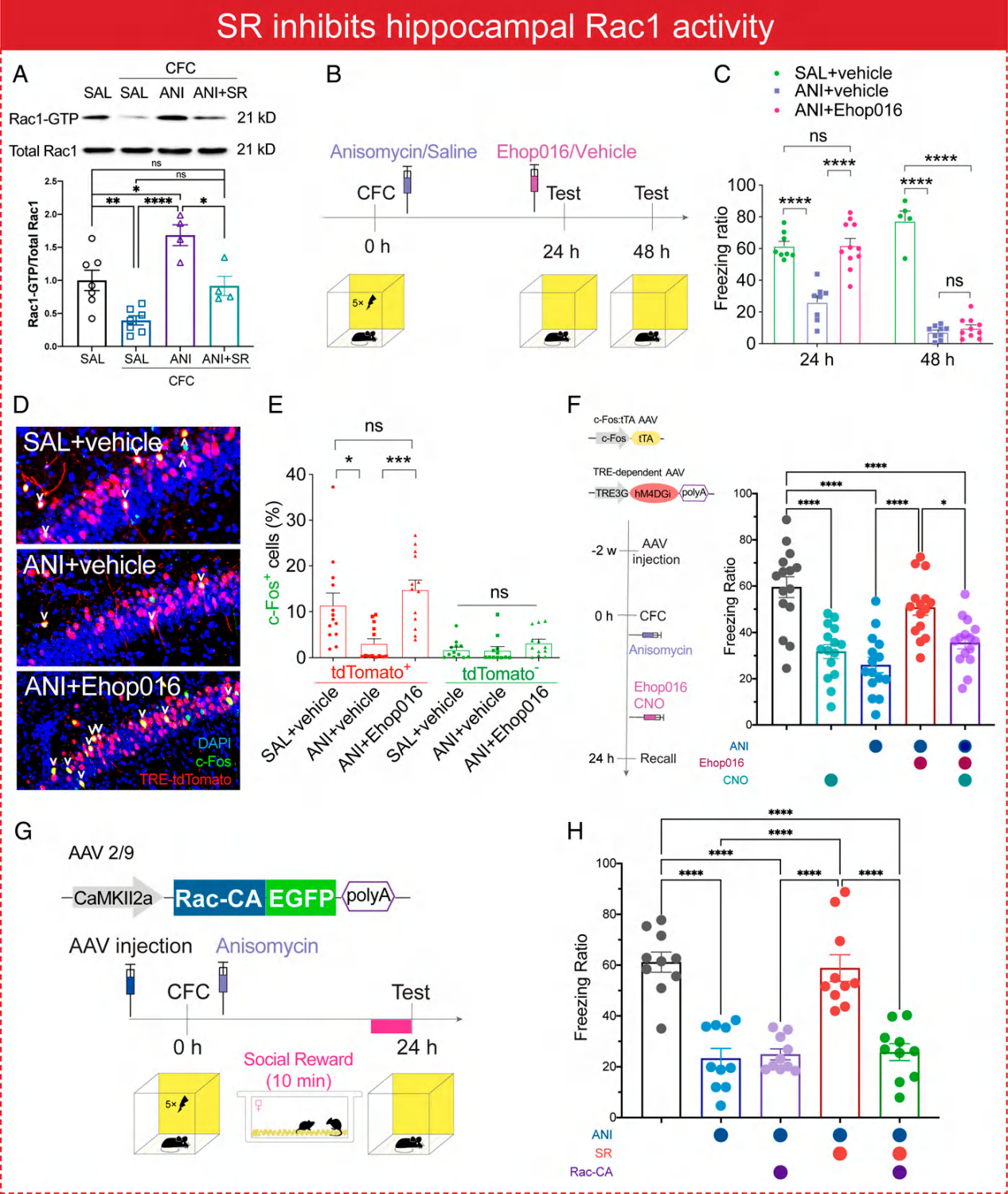
4.社交经历通过调节Rac1的活性影响记忆痕迹的状态
条件恐惧训练后给予ANI能明显增加Rac1的活性,而社交奖励能降低ANI引起的Rac1活性增加。对记忆痕迹细胞进行检测,发现社交奖励或腹腔注射Rac1的抑制剂Ehop016均能增加记忆痕迹细胞的数量。而在兴奋性神经元过表达Rac1则会取消社交奖励的效应。
图4. 社交奖励下调Rac1的活性增加记忆痕迹细胞数量
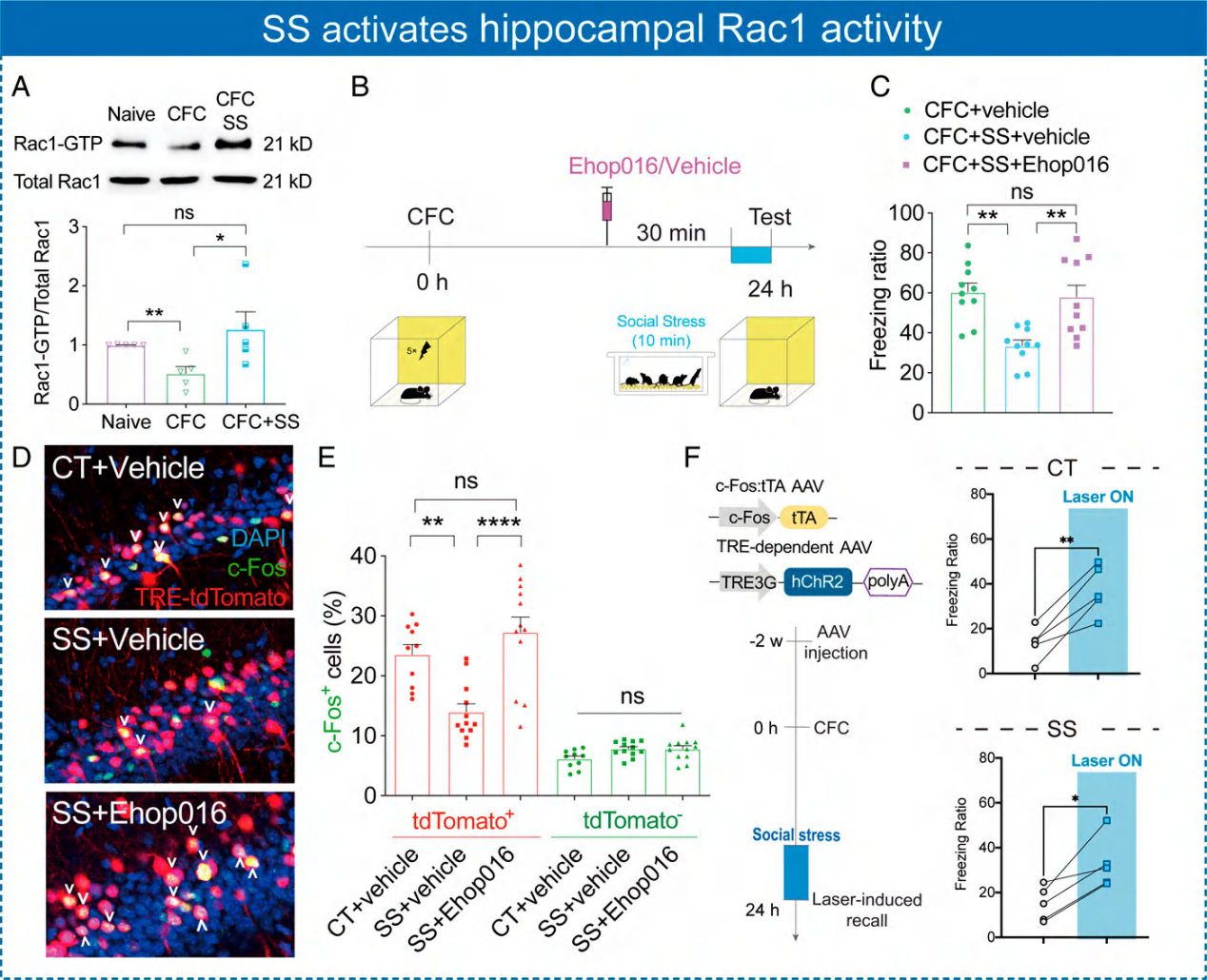
而在社交压力之后对海马脑区Rac1的活性进行检测,发现社交压力确实增加海马脑区Rac1的活性。使用Rac1的抑制剂Ehop016能恢复社交压力降低的恐惧记忆。对记忆痕迹细胞进行检测,发现社交压力降低记忆痕迹细胞数量,而使用Ehop016能恢复记忆痕迹细胞的数量。
图5. 社交压力增加Rac1的活性降低记忆痕迹细胞数量
结论
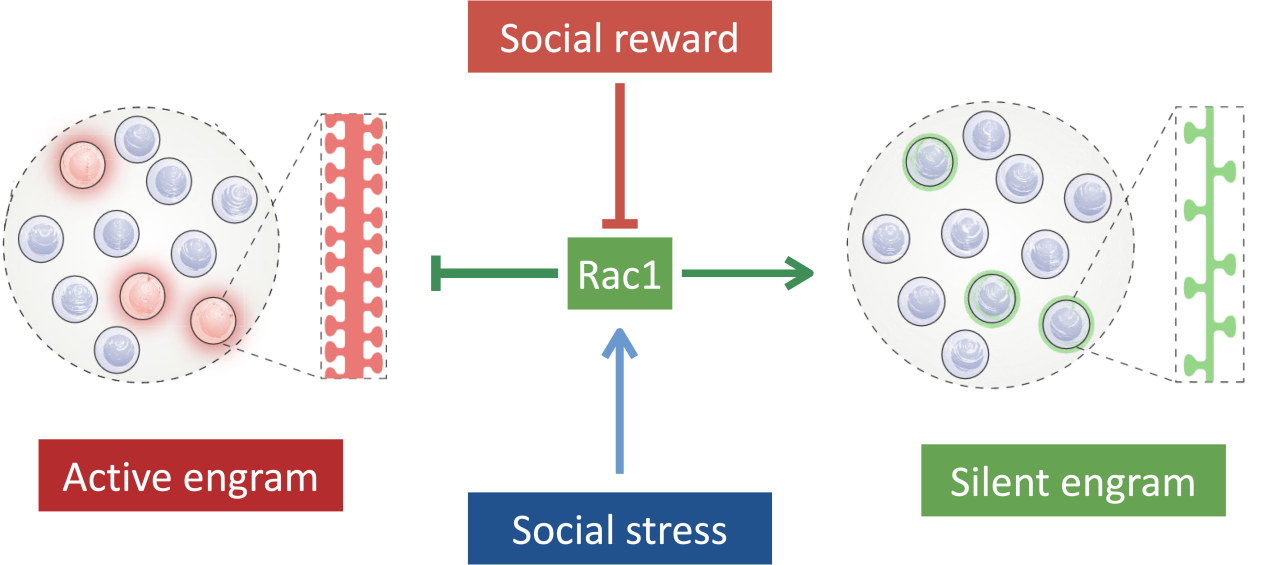
本文发现社会交往中的情绪状态能双向调节记忆痕迹的存储状态,社交奖励能通过抑制Rac1的活性,将静默状态的记忆痕迹转变为潜伏状态;而社交压力则通过增加Rac1的活性,将记忆痕迹由潜伏状态转变为静默状态。本研究提供了一个全新的神经生物学机制来帮助我们理解日常的情绪变化是如何通过切换海马体中的记忆痕迹状态来根据环境变化灵活调节记忆提取的。
模式图:情绪经历调节记忆痕迹细胞状态的神经机制

扫码下载原文
钟毅,清华大学生命科学学院教授、清华-IDG/麦戈文脑科学研究院PI、清华北大生命科学联合中心PI。现任中国神经科学学会常务理事、学习记忆基础与临床分会主任委员。长期从事学习、记忆和遗忘的生物机制研究,致力于推进人类记忆相关疾病病理机制的研究和潜在治疗药物的开发。已取得多项有影响力的研究成果,发表在Nature、Science、Cell等国际高水平期刊上。
清华大学生命学院2016级博士生雷博、2015级PTN博士生吕莉(已毕业)、2018级PTN博士生胡世强为本文共同第一作者,钟毅教授和博士生雷博为本文共同通讯作者。清华大学生命学院博士后唐义凯为本研究作出了重要贡献。本研究获得了国家自然科学基金委和清华-北京生命科学中心的经费资助。
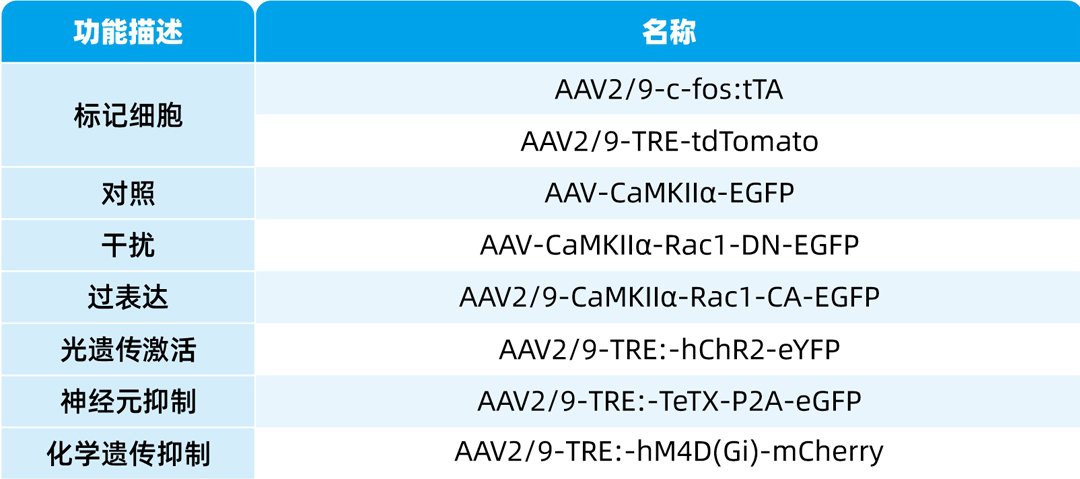
本文使用的病毒产品列表如下:

了解产品及服务请扫码
或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK