2021-12-23 阅读量:169
编者按
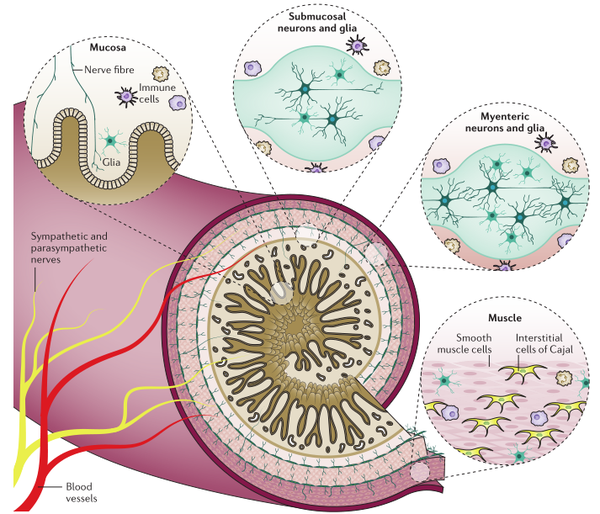
虽然肠道神经系统(ENS)不需要中枢神经系统的输入来执行局部功能,但来自自主神经系统交感神经和副交感神经分支的外源性传出神经,延伸进入肠壁并调节消化功能。
然而,大多数副交感神经支配是传入的,将感觉信息从肠道传递到中枢神经系统。虽然胃肠道的大部分功能还没有被意识到,内脏传入信号可在几种疾病和炎症后条件下发生严重改变,可能导致内脏过敏和疼痛。几十年的研究已经使人们对不同类型胃肠道细胞如何发育、存活和执行功能来协调如胃肠运动,粘膜分泌和营养吸收等行动,有了详细的了解。然而,由于所用实验方法的局限性,关键问题仍未得到解答。实现细胞特异性调控的困难在于空间分辨率差以及缺乏时间控制,这些困难阻碍了对肠道神经回路的组装、神经元-胶质细胞通讯、粘膜感觉、内脏伤害性感受、以及ENS和免疫系统之间的串扰的全面理解。而光遗传学和化学遗传学包括多种应用,其中基因编码工具(如指示器)用于调节和监测具有高度细胞特异性的活动。10年来,这些基因编码工具的开发极大地促进了对综合生理学的理解。随着探针的不断完善,针对特定细胞类型的转基因表达策略在过去的20年里也取得了很大的进步。虽然光遗传学和化学遗传学方法的创新主要由研究中枢神经系统的研究人员推动,但是这些技术对促进神经胃肠病学的研究也有很大的希望。小编在这里给大家推荐Boesmans W等发表在《Nature reviews. Gastroenterology & hepatalogy》题为“Optogenetic and chemogenetic techniques for neurogastroenterology”的综述文章,在这篇综述中,作者描述了当前可用的不同类别的工具,以及概述针对肠壁特定细胞类型的策略。讨论了光遗传学和化学遗传学技术在肠道中的可能性和局限性,并重点关注及概述这两种技术当前在肠神经系统中的用途。
一、光遗传学
光遗传学通常指基因编码的可以改变神经活动的光激活通道,包括光学激动剂和指示剂。光激动剂可控制细胞中的电化学信号,而光指示剂则用来报告这些信号。相比于传统电生理技术,光指示剂可以检测更大数量的细胞及其相互作用。特别是对于神经元放电过程中细胞内Ca2+浓度变化产生的高信噪比,对Ca2+水平的成像已成为记录神经活动的一种广泛使用的方法。
二、化学遗传学
化学遗传学是指使用基因工程大分子与特定合成分子或配体的相互作用。最常用的分子包括G蛋白偶联受体(GPCRs)和通过随机或定点突变修饰的配体门控离子通道,它们不再对内源性配体有反应,而是被合成的化学分子所激活。化学遗传学特别适合于操纵没有电压门控离子通道的细胞的活动,如胶质细胞和免疫细胞。
三、应用于胃肠系统的探针
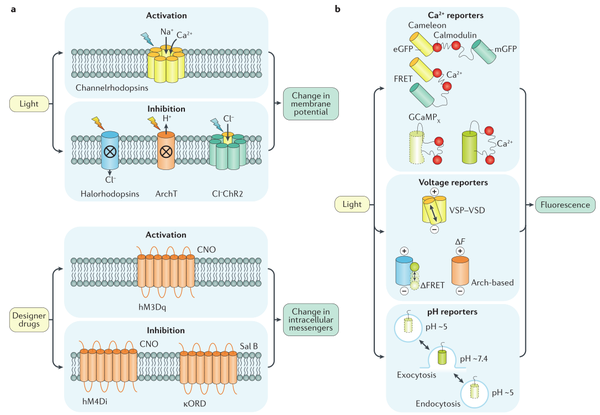
(一)基因编码光学激动剂
目前虽然已经开发了几种光活化蛋白,但视蛋白在神经科学中的应用仍主要集中在ChR2及其衍生物上。ChR2被蓝光(450–490nm波长)激活后产生非常快的内向电流,并在特定神经元中引起动作电位。目前ChR2-H134R变异体已经成为光遗传的首选工具,在多种转基因小鼠中广泛应用。
目前结构生物家还设计出不同的视紫红质通道变体。例如红移的视紫红质通道变体,其通道激活的激发光红移,大约在590-640 nm之间。这些变体包括阳离子传导视紫红质通道(VChR1)和ChR2红移变体(ReaChR)。此外还存在蓝移的视紫红质通道变体CheRiff和sdChR,该类型的变体可以和红移指示器同时使用。
(二)基因编码的荧光指示剂
1.基因编码的钙指示剂
基因编码的钙指示剂(GECI)在神经科学中也越来越受重视。虽然该类型不能精确地模拟膜电位的变化,但可放大神经元活动期间细胞内钙离子信号,显示出神经元的活动-静息差,从而提供了高信噪比,这使得GECI在显微镜系统中仍广泛运用。第一代GECI是基于一种双荧光蛋白的融合结构,其中使用了增强型绿色荧光蛋白(EGFP)的突变体。蓝色(EBFP))或青色(ECFP)的荧光突变体与发出绿色(EGFP)或黄色(EYFP)荧光的分子之间的荧光共振能量转移(FRET)发生在Ca2+与钙调素结构域结合,能很好的指示钙信号的变化。
2.基因编码的电压指示剂
大多数钙指示剂最重要的问题是时间分辨率太低。对于GECI来说,钙信号变化只有指示剂产生较强的荧光信号还需要发生构象的变化,因此存在一定的滞后性。为了克服这一限制,科学家开发出基因编码电压指示剂(GEVI)。该类型指示剂中一部分是基于FRET原理,另一部分则是依赖于电压敏感型磷酸酶(VSP)的电压敏感域(VSD)的特性。虽然荧光强度的变化比GECI发生得更快,但该指示剂仍然不能很好地应对动作电位放电的瞬时动力学特征。
3.用于突触传递成像的pH敏感指示剂
除了钙指示剂和电压指示剂之外,还有pH敏感的指示剂用于细胞pH变化精确成像。pHluorin是一类pH敏感的指示剂,该指示剂是一类融合蛋白,由突触小泡蛋白synaptobrevin 2(也称为囊泡相关膜蛋白2)与超黄道GFP融合而成,在pH 5.0时荧光发生猝灭,在pH 7.4时显示出较强的荧光信号。因此,被用作突触传递的指示剂。当指示剂在pH 5.0的富含神经递质的突触小泡内时,该指示剂不产生荧光信号,在囊泡融合时,指示剂暴露在pH 7.4下,会发出明显的荧光信号。
四、靶向基因编码工具
与其他报告或调节细胞活动的方法相比,基因编码探针的关键优势在于可细胞特异性的进行干预。本部分研究关注于对肠道内特定的细胞类型进行光遗传学和化学遗传学的不同策略。
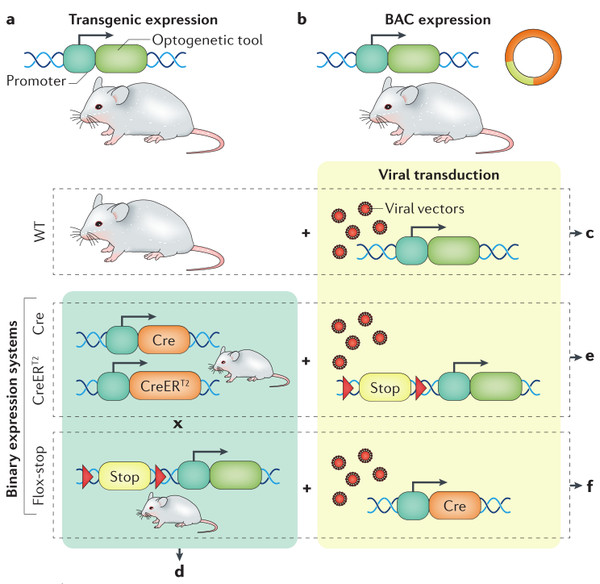
1.基因敲入和BAC转基因
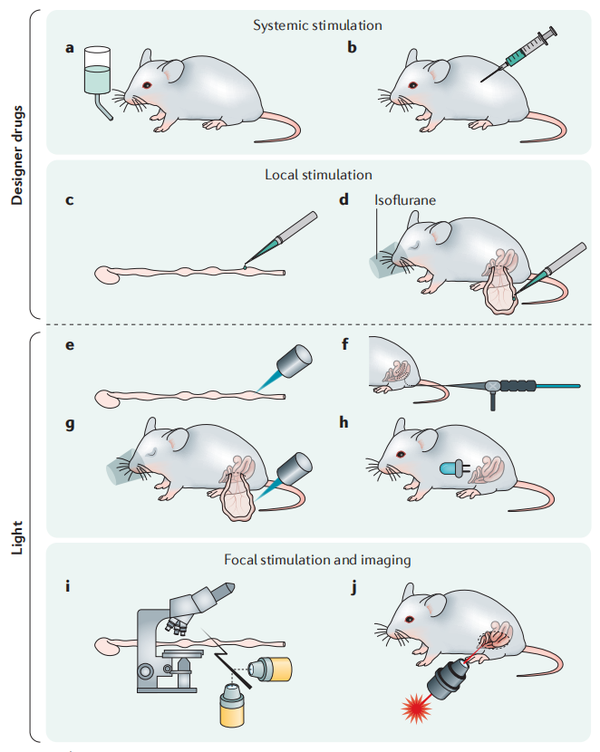
光遗传和化学遗传学的转基因手段可以通过将目的基因插入到细胞特有的“标记基因”的位点中。在确定导入基因的表达时,需要仔细考虑基因整合的具体位点和方法。为了最大限度地减少内源基因表达的中断,转入的基因通常整合到内源基因的最后一个外显子中。内部核糖体进入位点序列(IRES)广泛运用于转入基因的表达,但IRES序列可降低内源性基因的表达。小鼠大脑中,强泛神经元启动子Thy1通常用于基因的过表达。然而,Thy1的表达模式根据插入拷贝数和染色体整合位点的数量而有所不同,导致随机神经元选择。细菌人工染色体(BAC)转基因方法是将目的基因插入到内源性基因的特定位点,在BAC内保存一个大片段的基因组。然后BAC被完全整合到基因组中的一个随机位置,构建出BAC小鼠品系。
2. 二元表达系统
条件性表达基因编码探针的最常用方法涉及两个组件的系统,啮齿类动物中基于Cre重组酶驱动和Cre重组酶依赖的二元组合表达体系在包括神经胃肠病学中广泛应用。在该方案中,基于内源性标记基因的活性,通过转基因驱动Cre在特定细胞类型中表达,建立Cre小鼠品系。Wnt1–Cre常用于神经嵴谱系包括ENS的神经元和胶质细胞中的条件性报告基因表达。此外Cre重组酶也可以加入诱导系统,可以进一步指定遗传编码基因表达的条件,从而能时间特异性的调控基因的表达。通常情况下,他莫昔芬(Tamoxifen)诱导的CreERT2(诱导型Cre变体)是编码时空调控的主要手段,CreERT2的雌激素受体(ERT2)结合位点突变能阻止Cre进入细胞核,而当ERT2和他莫昔芬结合后,Cre进入细胞和诱导基因的表达。四环素(Tet)依赖的二元基因表达系统(tTA-TRE)也是一种常用的手段。Tet响应元件在四环素或其衍生物存在(Tet-on)或去除(Tet-off)诱导开启基因的表达。
重要的是要意识到特别是在胃肠生理方面,其中一些二元转基因系统中使用的药物可能的不利影响。口服或腹腔注射他莫昔芬后,已被证明能诱导胃壁细胞凋亡和酶原性主细胞化生。作为抗生素,四环素及其衍生物强力霉素可能对肠道微生物群有重要影响。
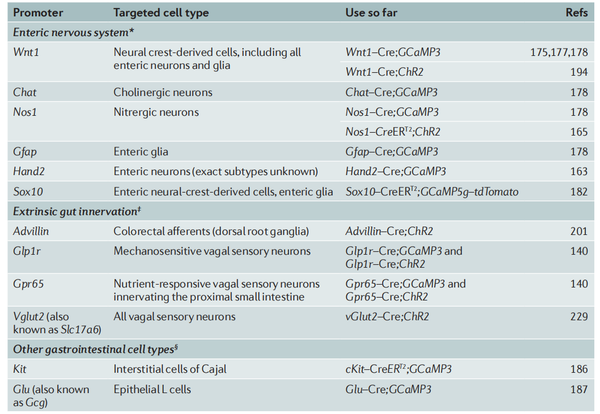
表1. 可用于神经胃肠病学中的光遗传学和化学遗传学研究Cre驱动品系
3. 病毒传导策略
与神经胃肠病学相关的细胞类型也可以被病毒载体转导以表达光遗传学和化学遗传学蛋白。通过使用特定的基因启动子可以实现细胞特异性,但对于病毒载体,不同病毒种类的固有趋向性以及工程化衣壳蛋白变化可带来额外的血清型之间的选择性。大多数使用病毒载体在肠道中转导细胞的体内研究主要集中在胃肠粘膜上,很少关注肠神经元。近几年来,据报道啮齿动物中肌肉注射或静脉注射腺相关病毒载体(AAV)已成功转导ENS。因为AAV血清型(AAV6、AAV8或AAV9)似乎是肠神经元亚型向性的主要决定因素,强但非特异性的启动子可以用于靶向肠神经元的转基因表达。另一方面,胶质细胞特异性启动子可靶向肠胶质细胞。此外,当AAV9与广谱CAG启动子结合经尾静脉注射使用时,发现基因编码的光遗传学工具可以不仅靶向肠神经元,还能同时靶向Cajal间质细胞。鞘内注射和迷走神经神经节注射病毒载体也可用于靶向肠道的外源性神经支配。用于注射的病毒载体的最佳滴度根据所需的转导细胞水平和数量、注射部位,载体血清型和启动子活性有很大差异。在大脑中,神经元亚型通常既定位于特定的功能定义区域,又投射到特定的功能定义区域,这意味着逆行病毒载体可用于通过远端立体定向注射转导特定神经元群轴突末梢靶向表达转基因。类似的战略在靶向支配胃肠道的外源性传出神经应该是可行的。
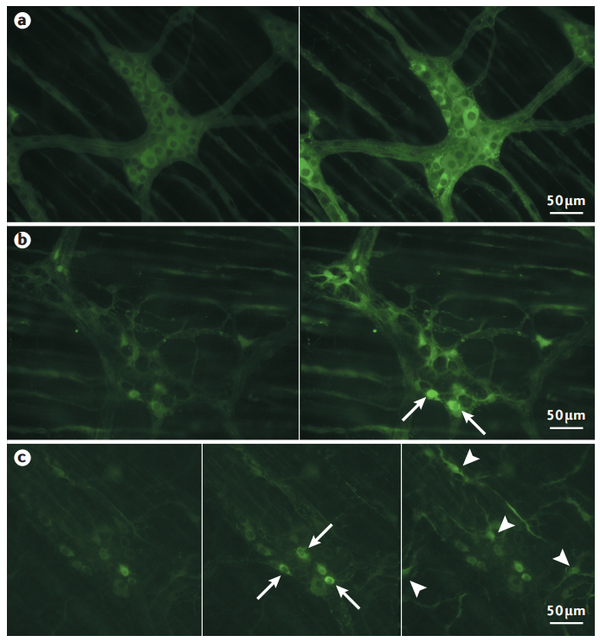
a:Wnt1–Cre;R26R–GCaMP3小鼠GCaMP3在肠神经元和胶质细胞中的表达;
b:Sox10-CreERT2;GCaMP3小鼠他莫昔芬给药后肠胶质细胞中GCaMP3表达;
c:成像前2周尾静脉注射转导AAV9.CAG.GCaMP6f.WPRE.SV40载体的小鼠肠肌间神经丛中GCaMP6f的表达。
五、神经胃肠病学的应用
1.肠壁细胞和肠道神经系统
GECI GCaMP是迄今为止研究肠道功能最广泛的工具。为了检测ENS的功能,许多研究已经使用Wnt1-Cre;Rosa26-GCaMP3小鼠在肠神经元和胶质细胞中驱动GCaMP3的表达。LSL(Lox-STOP-Lox)–GCaMP3小鼠出现后不久,发现GCaMP3有助于在肠组织的离体制剂以及分离的肌间神经元的体外培养中研究肠神经元和胶质细胞之间的信号传导。ENS中表达GCaMP的主要优点是可以在完整肠道制剂中成像,避免了通过解剖去除表层组织层的繁琐步骤,这对于装载合成的钙离子指示剂染料很重要。而这一特性对胚胎肠道的研究尤其有益(胚胎肠道解剖及装载合成指示剂都非常困难)。Wnt1-Cre;rosa26-GCaMP3小鼠在ENS中GCaMP3的明亮表达可利用活体钙成像研究胆碱受体亚型的发育及其在内源性胆碱能传递中的作用。由于可以通过外层浆膜细胞层直接进行成像,胚胎肠道得以保持完整,可进一步研究肠神经元的突触连接。
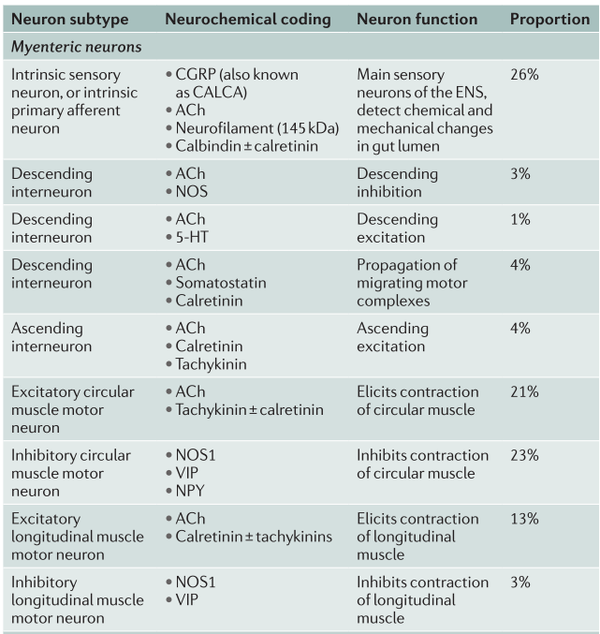
除Wnt1-Cre小鼠外,还有其他Cre驱动的转基因小鼠表达GCaMP3用于肠神经元的研究,包括研究胆碱能神经元的胆碱乙酰转移酶(Chat)-Cre和氮能神经元的神经元型一氧化氮合酶(Nos1/nNOS)-Cre。表达CHAT的肠神经元包括固有感觉神经元、几类下行中间神经元和兴奋性运动神经元。同样,因为一氧化氮作为ENS中一种重要的抑制性神经递质,以及nNOS的产物是由抑制性运动神经元和一类下行中间神经元同时释放,使用nNOS-Cre小鼠也不会驱动单一种类的肠神经元中的基因表达。
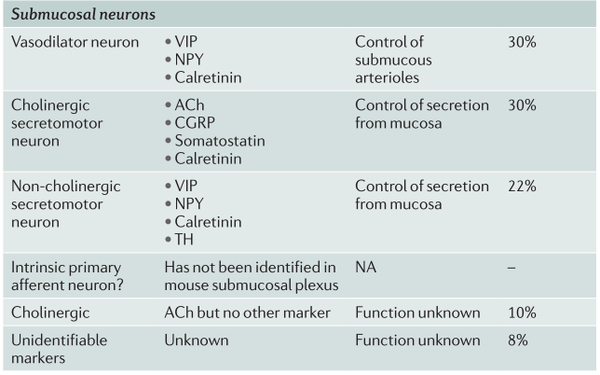
表2. 小鼠小肠中肠神经元的神经化学编码
2. 与中枢神经系统的功能连接
除了肠壁中细胞和调控组分外,与中枢神经系统(CNS)的通讯也已通过光遗传学和化学遗传学工具的使用在一些研究中解决。特别是,肠道体液输出对食欲中枢控制的影响以及微生物组对大脑功能的影响已经成为许多调查的主题。一项研究中使用光遗传学刺激生长抑素阳性GABA能神经元(表达ChR2的运动背核迷走神经)后大脑切片显示光刺激抑制了投射到胃窦的运动前神经元。作者使用ArchT小鼠系同样发现使用黄光刺激后可以抑制相同的的神经元群。在小鼠下丘脑弓状核中表达刺鼠相关蛋白(AGRP)的神经元中特异性地表达DREADDs,注射CNO给予刺激,导致小鼠的摄食量明显增加。而在穹窿下器通过脑立体定位注射表达hM3q后,注射CNO给予急性刺激,小鼠饮水量增多,对盐的食欲增加。
六、当前挑战和未来应用
基因编码工具的靶向性主要取决于被认为可以区分细胞类型的标记基因的表达,因此转基因表达的特异性取决于识别这些细胞类型的能力。目前小鼠肠神经元亚型的分类是基于非常有限的免疫组化的标记方案,但这种分类是通过某些标记的组合表达进行的,可能与特定的神经元亚型的功能不完全匹配。另外,目前可用的靶向细胞群的启动子,如nNOS和Chat,由于在多个功能定义的亚型中均可表达,并不能用于描绘特定的肠道神经元亚型。因此,要正确探测功能,面临的挑战将是仔细设计专门针对ENS的基因系统。单细胞转录组学的出现可能有助于识别可用于更好地定义细胞亚型的候选标记基因。肠道神经元亚型似乎相当随机地分布在肠道内肌间神经丛和粘膜下神经丛的单个神经节。神经元亚型的分散分布使得利用光遗传学绘制肠道神经回路变得没几个大脑区域所做的那么简单。目前已知的ENS特异性标记基因有限,加上肠道神经元看似随机的分布,也意味着大量应用刺激(光遗传学或化学遗传学)不是探测肠壁中细胞网络的理想方法。此外,目前对不同肠神经元之间的突触联系知之甚少。
光遗传学技术可以取得重要进展的另一个领域是内脏传入的伤害感受和超敏反应。例如,通过在选择性外源性传入神经元中表达兴奋性视蛋白,可以建立局部传入可被滴定光刺激激活的实验模型。光遗传学也有助于研究肠道胆碱能抗炎途径。类似于在大脑中使用光刺激来研究胆碱能信号在炎症反射调节中的作用的研究,ChR2可以靶向支配胃肠道的迷走神经传出纤维。无论表达水平如何,例如,通过使用Kit、Ano1或Pdgfra调控元件来驱动视蛋白表达,特定间质细胞类型的光遗传学激活或抑制有助于区分这些细胞网络如何影响胃肠道不同区域和层次的平滑肌功能。与光遗传学指示剂和激动剂相比,化学遗传学和药物遗传学工具不存在光穿透等问题。对于这些方法,未来发展的重点将是改善激活或抑制的时间调节,并确保不存在组成型受体活性。此外,设计药物(或其代谢物)不应从天然受体中引发任何生物活性,或者更广泛地说,无论受体相互作用如何,都不会产生生理效应。在解释化学遗传学方法的结果时,重要的是要考虑到相比于光遗传学技术,反应动力学较慢和作用时间较长。由于大多数神经细胞类型的输出依赖于放电频率,而不是长期去极化,因此与光遗传学工具相比,化学遗传学方法可能不太适合于触发和研究神经元功能。
七、结论
在过去的15年中,光遗传学和化学遗传学工具已经彻底改变了我们对细胞成像和与细胞互动的方式,并提高了我们对神经回路和综合生理学的理解。本文作者总结了目前可用的基因编码工具,利用光遗传学和化学遗传学工具研究ENS和脑-肠轴调节胃肠功能的基因靶向策略和成像方法。可以清晰发现神经胃肠病学领域才刚刚开始利用基因编码的激动剂和指示剂。尽管一些技术和实际问题(如肠道神经元的异质性和空间分布)仍需要仔细关注并需要注意胃肠道特异性,显然,这些基因方法的未来是光明的。
原文链接:https://sci-hub.se/10.1038/nrgastro.2017.151

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK