2022-01-01 阅读量:265
编者按
光控工具提供了强大的操纵和探索大脑功能的手段,并具有相对较低的侵袭性和较高的时空精确度。尽管光遗传学方法允许神经网络水平上的神经元兴奋或抑制,其他技术,如光控药理学也出现了通过赋予内源性生物分子光敏性来提供分子水平的控制。小编在这里给大家推荐Paoletti P等发表在《Nature reviews.Neuroscience》题为“Optical control of neuronal ion channels and receptors”的综述文章,本综述中,作者专注于离子通道和神经递质受体,讨论了光控制天然神经元信号通路的挑战和机遇,描述了使受体和通道光敏的现有策略,并概述了从这些方法中获得的神经科学见解。在化学、蛋白质工程和神经科学的十字路口,光控药理学为理解大脑功能和行为的分子基础提供了巨大的潜力,并有望为未来的治疗提供前景。
背景
离子通道和受体控制神经元的膜电位和兴奋性,调节突触传递和神经元信息通讯。神经元离子通道和受体涉及到许多神经精神疾病,并且有大量的神经精神疾病以离子通道和受体为治疗靶标。但是神经元离子通道和受体具有多样性,每个受体家族都由许多亚型组成,并具有不同的分布和特性,不同的亚型组成的受体具有高度异质性。到目前为止,电生理学、分子生物学、遗传学、生物化学、药理学和结构生物学的研究,已经为离子通道和受体的结构和功能提供了大量的实验信息。然而,仍缺乏在活体组织中在时空分辨率尺度上研究特定离子通道和受体亚型的方案。光遗传学的进步加深了我们对潜在行为相关神经环路的理解,它可以在时空分辨率的尺度上调控特定类型神经元的活性。然而,传统的光遗传学仍缺乏在时空分辨率尺度上研究特定离子通道或受体的能力。光控药理学是指通过修饰内源性蛋白质靶标增加蛋白的光学敏感度,从而能在时空尺度上理解分子功能对大脑的调控作用。
一、光控药理学的设计方案
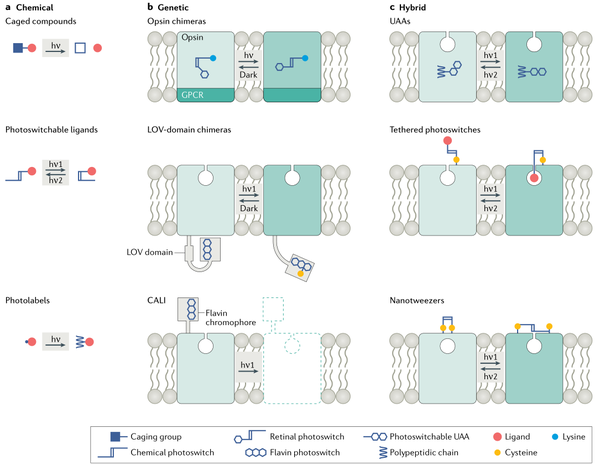
在光控受体和离子通道的设计中,主要有三种方案。化学方案:不对目标蛋白进行修饰,而是完全依赖于外源光敏化学物质;遗传方案:需要对目标蛋白质进行基因修饰;混合方案:即同时涉及遗传和化学修饰的二元系统。这些方法中的每一种都有相应的优点和局限性。选择正确的方案取决于人们感兴趣的生物学问题和靶标蛋白对基因改造的适应性。
(一)化学方案
化学方案是以天然(即未修饰的)蛋白质为靶标,将光敏感化学物质连接在目标蛋白质上。目前已经开发的化学方案包括光解笼系统、光控转化配体和光亲和标记。该方案的优点是不需要通过基因修饰就能赋予内源蛋白质光敏感度,但是可能对其分子靶标调控缺乏精确的特异性。
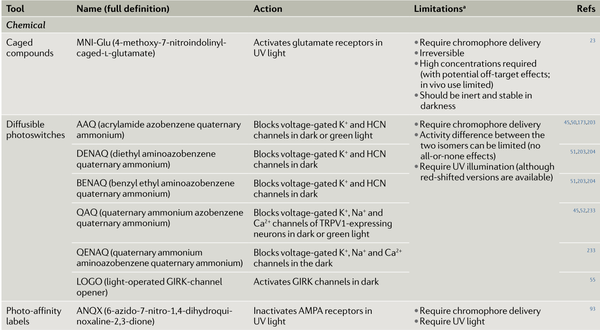
1.光解笼系统
光解笼系统含有一个可被光移除的保护基团,在光刺激下保护基团被移除,导致生物活性分子的快速释放。这种化合物在黑暗环境中是惰性的(就像被关在笼子里),而光照后导致生物活性分子浓度迅速增加。光解笼配体是神经科学中应用最广泛的光化学物质。
2.光控转化配体
光控配体含有光异构化的基团,与光解笼系统不同,光控配体可在两种不同波长的光下可逆地在活性和非活性的形式之间转化。这导致了目的蛋白可逆的开关控制。使用两种不同波长的光来驱动蛋白分子光开关的激活和非激活状态,可以实现蛋白分子激活和失活的精确时间控制。
3.光亲和标签
光亲和标签(PAL)包含光反应基团,该基团在光刺激下被转化为反应性烷基化实体。PAL在黑暗环境中可逆性地与受体结合,但在光激活后永久性地和受体结合。因此,该方案可以“捕获”处于永久激活(或抑制)状态的受体或离子通道。PAL目前被广泛运用于各种神经元离子通道和受体的研究,包括环核苷酸门控通道、GABAA受体、nAChRs和AMPA受体以及各种G蛋白偶联受体(GPCRs)。
4.生色团辅助激光灭活
生色团辅助激光灭活(CALI)依赖于合成染料(如孔雀绿、荧光黄或曙红)在光刺激时释放不稳定的活性氧(主要是单态氧),进而通过氧化氨基酸侧链以及蛋白质交联导致邻近蛋白质的损伤和不可逆失活。CALI可以通过抗体靶向特定的内源性膜蛋白,如AMPARs。
(二)遗传方案
遗传方案需要在靶蛋白中加入一个基于基因编码的光敏模块,从而产生一个完全由基因编码的光响应受体或离子通道。与化学方案相比,遗传和混合方案有一个显著的优势:可以构建具有分子和细胞特异性的光响应受体或离子通道。通过将来自于动物、植物和微生物的光感受器与哺乳动物蛋白分子相融合,特殊情况下可以将光感受器与膜受体或离子通道融合。
自然界的光感受器包括含有内源性视网膜光开关的视蛋白,黄素蛋白的敏感结构域,以及隐花色素(CRY2)结构域。
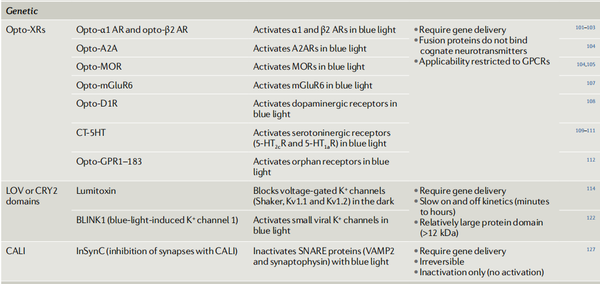
1.视蛋白
视蛋白属于GPCR超家族,可改造成嵌合受体,具有细胞内(光不敏感)神经调节环的GPCRs能产生光可控受体(opto-XRs)。肾上腺素能受体、阿片受体、多巴胺受体等均可实现信号的光控制。
2.LOV和CRY2结构域
LOV(光氧电压)结构域包含黄素单核苷酸发色团,而CRY2结构域包含黄素腺嘌呤二核苷酸发色团。蓝光激发会使这些植物结构域产生主要构象变化,具体地说,即去折叠的LOV结构域与CRY2与CIB1的二聚反应,可用来调节蛋白与蛋白之间相互作用,及亚细胞精度的蛋白质定位。来自于植物的光感结构域是分子量相对较大(约12–19 kDa)的蛋白模块,具有缓慢的开启和关闭的动力学特征。因此主要被用来控制缓慢的细胞过程,例如轴突生长、细胞内信号级联、基因表达或蛋白质定位,而较少用于操纵快速信号事件,如神经传递。
离子通道可以通过将LOV结构域融合到伴侣蛋白(如K+通道毒素或细胞内钙离子传感器蛋白基质相互作用分子1(STIM1,与钙离子释放激活通道相互作用并激活该通道)间接光敏化。LOV结构域也可以与GTP(鸟嘌呤-5'-三磷酸)酶融合,从而通过光控制电压门控钙通道或树突棘大小。CRY2的光控制已成功用于抑制特定微结构域中的G蛋白信号和通过改造的肉毒杆菌神经毒素控制神经递质释放。仅在少数例子中,LOV或CRY2结构域直接融合到膜蛋白本身,如K+通道、酪氨酸激酶受体、AMPAR,以控制它们在兴奋性突触中的丰度。
3.生色团辅助激光灭活
基因编码的融合蛋白也可用于CALI方法中,可作为锚定光敏模块或直接充当单态氧发生器的蛋白模块的标签。
(三)混合方案
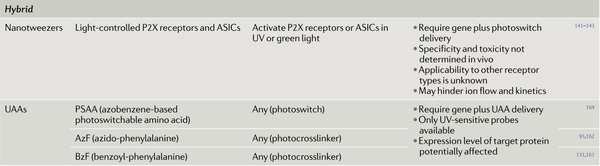
混合方案是利用化学和遗传方案,通过光化学工具精确地操纵和控制蛋白质的功能,这些工具被遗传修饰固定在所需的膜蛋白上。混合策略通常采用非天然氨基酸(UAA),因为UAA几乎可以通过遗传密码扩展插入到目标蛋白质的任何位置。光响应型氨基酸已被证明是操纵膜受体和离子通道的强大工具。
光调控的栓样配体(PTLs)是另一种光响应性方式调控受体和离子通道的有效方案。该方法依赖于光控转换配体的共价连接,通过单个半胱氨酸取代的方式结合到更大的蛋白质标签进行连接。
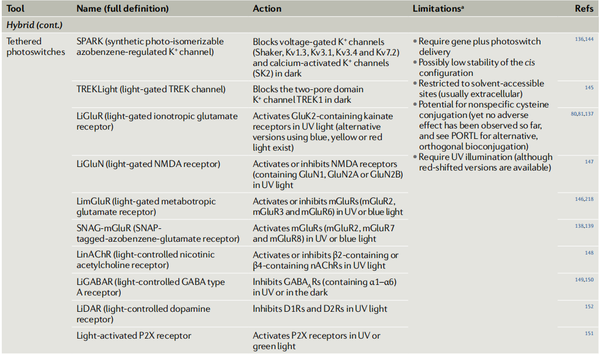
图1. 光控药理学的主要策略
表1. 神经生理学中使用的主要光控药理学工具
5-HTR,5-羟色胺受体;A2AR,腺苷2A受体;AR,肾上腺素能受体;ASIC,酸敏离子通道;CALI,生色团辅助激光失活;CRY2,隐花色素2;CT,羧基末端;D1R,多巴胺1受体;GABAAR,GABA A型受体;GIRK通道,G蛋白偶联内向整流钾通道;GPCR,G蛋白偶联受体;GPR1,G蛋白偶联受体1;HCN,超极化激活环核苷酸门控;Kv,电压门控钾通道;LOV,光氧电压;mGluR,代谢型谷氨酸受体;MOR,μ阿片受体;nAChR,烟碱型乙酰胆碱受体;PORTL,光控开关的正交远程栓系配体;SK2,小电导钙激活钾通道蛋白2;SNARE,可溶性N-乙基马来酰亚胺敏感因子激活蛋白受体;TRPV1,瞬时受体电位V1;UAA,非天然氨基酸;UV,紫外线;VAMP2,囊泡相关膜蛋白2。
二、受体和离子通道的功能研究
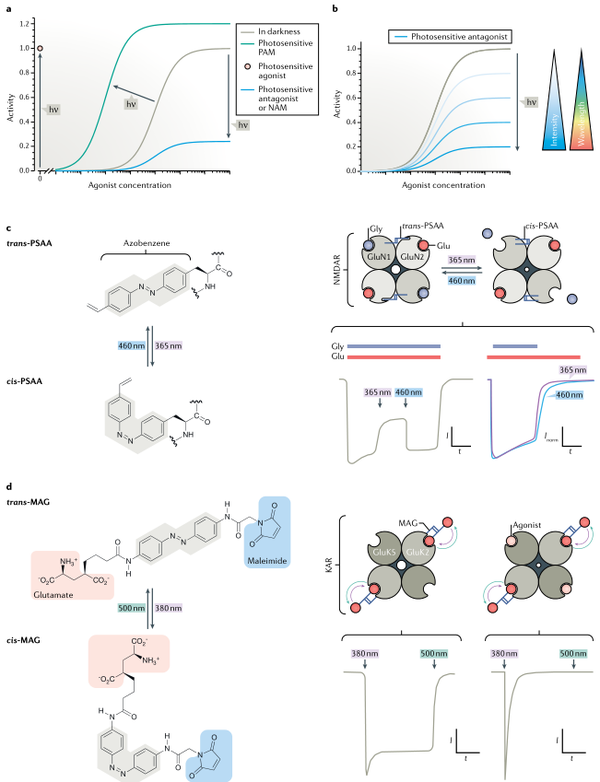
受体和离子通道的核心生物物理特征包括:配体受体结合、激活和门控动力学特点以及离子渗透。这些生物物理特征都可以使用光控药理学进行功能研究。光可作为执行器充当全或无开关,允许直接激活离子通道或受体,光也可作为调节器,调节由同源刺激激活的受体或离子通道的活动。光还可以模拟激动剂(完全、部分或反向)、拮抗剂(竞争性或非竞争性)、通道阻滞剂和开放剂,或负性或正性变构调节剂(NAMS或PAM)。使用不同的光强度或者不同的波长来引起受体或离子通道功能改变,可实现对分子靶点的精细化控制。因此光控药理学为受体和离子通道的研究提供了精确的时间和空间研究工具。光解笼激动剂允许配体的快速递送(<25µs),这对于研究受体启动的动力学特征非常使用。PTL的快速光控允许对配体进行结合和解离的亚毫秒级调控,可以解析多聚体复合物中通道门控的调控机制。
图2. 光控离子通道和受体的生物物理和药理特征
三、光控药理学研究神经生理过程
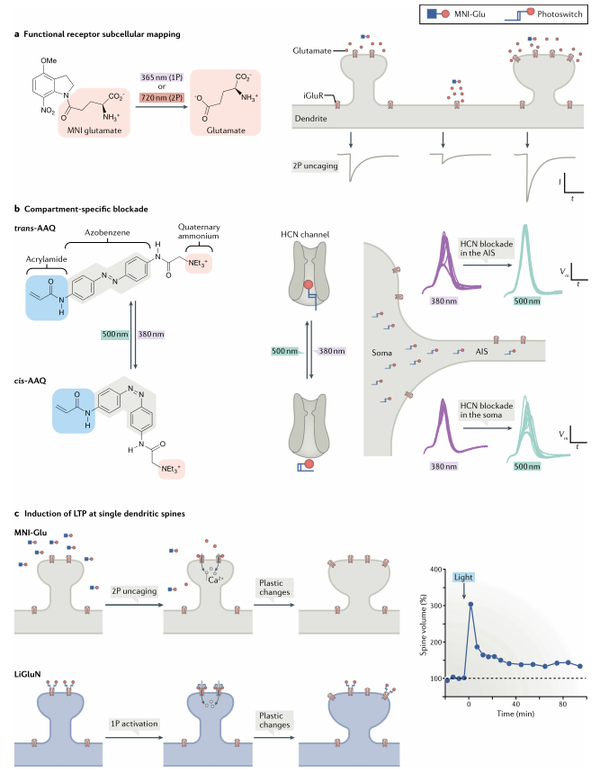
光控药理学允许在电生理或药理学手段难以接近的位置(如亚细胞结构、突触前和突触后部位等)调节离子通道和受体,为理解神经生理学打开了新的窗口。光解笼的神经递质,特别是谷氨酸和GABA,是第一批对神经生物学产生重大影响的光控化学工具,可以在亚毫秒的时间尺度上模拟突触前神经递质释放过程,研究递质释放的动力学特征。
此外光控药理学还可以研究神经元中离子通道和受体是如何运输和定位的,特定的受体和离子通道可以使用适当的光控配体。在脑片谷氨酸研究实验中发现,功能性AMPAR的表达与锥体神经元中的树突棘的大小和几何形状密切相关,蘑菇型中含有AMPAR的数量最多。利用丙烯酰胺偶氮苯季铵盐(AAQ)的光敏通道阻断剂的特性,发现位于神经元轴突起始段(AIS)的超极化和环核苷酸门控通道(HCN)控制动作电位的阈值和频率。
图3. 光控药理学研究神经生理过程
四、光控药理学研究突触功能
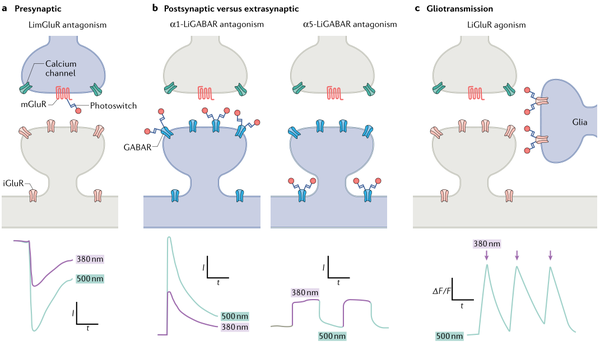
光控药理学通过细胞类型和亚结构的特异性,使用遗传和混合方案对突触功能进行研究。例如,可溶性N-乙基马来酰亚胺敏感因子激活蛋白受体(SNARE)蛋白与基因编码的光灭活剂融合,在空间和时间上尺度上可以精确地干扰大鼠海马脑片和秀丽线虫的突触前囊泡释放。
PTLs和OPTO-XRs则有可能被用来研究受体和离子通道在不同的突触部位(包括突触前、突触后和突触外)中的作用。例如,在果蝇神经肌肉接头处,当突触后表达的光控红藻氨酸类型谷氨酸受体(LiGluRs)被特异性激活时,就引起突触前神经递质释放增加。含有α1亚基和α5亚基的光控GABA亚型(LiGABARs)分别研究突触和突触外功能。
图4. 光控药理学研究突触功能
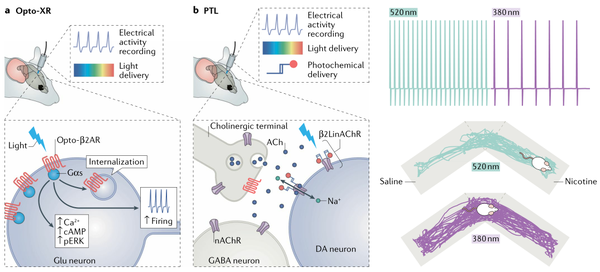
五、光控药理学在活体水平的运用
现代神经药理学的一个基本目标是将特定神经环路中受体活性的变化与神经元活性、环路改变和行为学效应联系起来。经典药理学方式在活体实验中很难实现这一目标,因为传统药理学局部给药速度慢,不精确,并且很难与电生理学兼容。相比之下,光控药理学为解决这个难题提供了良好的实验平台。
在混合方案中,半胱氨酸UAA取代单个氨基酸在最小程度对靶蛋白进行修饰,因此修饰后的受体或离子通道除了具有光控特性外,和正常蛋白没有区别。通过工程化的半胱氨酸连接到谷氨酸受体上的PTL技术,在小鼠身上已经进行应用。
表达PTL突变亚基的方法有两种:病毒表达和转基因敲入鼠。相对而言,使用转基因小鼠是比较好的策略。例如,在腹侧被盖区(VTA)过表达的LinAChRs导致突触后胆碱能传递的功能受损,但不影响VTA传入神经元突触前nAChRs的功能。
图5. 光控药理学在活体水平的运用
六、总结与展望
光控药理学凭借其高度的灵活性和多功能性,目前已产生了大量的光控配体、光控离子通道和神经递质受体,允许在细胞、环路或生物体内特定位置对特定神经元信号通路进行快速远程控制。光控药理学通过建立起蛋白质功能和细胞或行为表型之间的因果关系,在解锁大脑分子逻辑方面潜力无语伦比,还具有鉴定神经系统疾病新治疗靶点的巨大潜力。还可以用于探索正常和疾病状态下多种受体和离子通道亚型在生理环境中的作用和信号机制。事实上,任何膜相关或可溶的蛋白质,只要其活性可由相互作用配体或结合伴侣蛋白控制,都可以进行光控药理学改造。
目前各种生物(包括非动物生物)基因组测序技术的蓬勃发展预示着使用天然光敏模块的生物技术应用前景光明。神经科学将从光遗传学和光控药理学的进步中受益匪浅。而照射神经组织的侵袭性更低的方法也已出现,有些甚至不需要手术。以光为基础的光控药理学方法,无疑将继续在解析大脑生理学和病理学基本过程中形成新视野。
原文链接:https://sci-hub.se/10.1038/s41583-019-0197-2

扫描下载原文

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK