2022-11-07 阅读量:843
胰腺炎是胰腺组织的炎症性疾病,包括急性胰腺炎和慢性胰腺炎。急性胰腺炎(AP)的患者会表现出严重的左上腹腹痛,有非常高的概率发展为全身系统性炎症甚至多器官功能障碍(MODS)[1]。AP的反复多次发作会导致慢性胰腺炎(CP),表现为慢性的胰腺炎症和胰腺纤维化,从而引发胰腺分泌功能障碍,最终影响寿命[2]。到目前为止,临床上胰腺炎没有有效的治疗药物。AP最主要的发病原因是胆结石病(40%)[3],胆结石一旦堵塞胆胰总管,会导致胆汁无法正常排出而返流到胰腺导管中,返流的胆汁会机械性和化学性的损伤胰腺导致胰腺炎。研究表明,胆汁酸受体GPBAR1是引发胆源性胰腺炎的必要因素[4, 5],然而,FXR作为另一个重要的胆汁酸受体,在胰腺炎中的功能作用还不清楚。
2022年11月2日,江南大学/复旦大学孙宁研究员团队在Research杂志发表题为“Activation of Pancreatic Acinar FXR Protects Against Pancreatitis via Osgin1-mediated Restoration of Efficient Autophagy”的研究论文。本文中,作者发现胰腺腺泡细胞中的FXR对于胰腺炎具有保护作用。
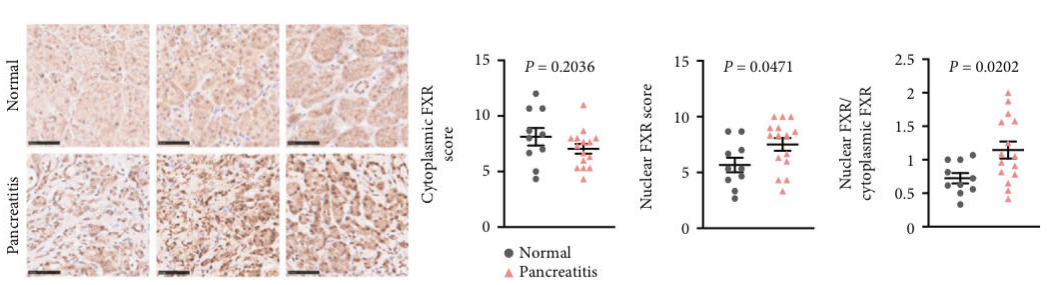
作者首先观察了胰腺炎患者胰腺组织中FXR的表达水平。结果显示,胰腺炎患者组织胞核中的FXR显著上升,且胞核FXR与胞浆FXR的比值显著上升。接下来,作者发现,在雨蛙素诱导的小鼠胰腺炎模型中,小鼠胰腺组织胞核FXR水平也显著上升。这些结果表明,胰腺组织中的FXR在胰腺炎中被上调。那么,这种FXR的上调对于胰腺炎来说起到了什么样的作用呢?作者构建了FXR胰腺腺泡细胞特异敲除的小鼠(FXRacinarΔ/Δ),并在这种小鼠上进行了AP和CP的造模。结果发现,FXR胰腺腺泡的敲除会导致更加严重的胰腺炎。这表明FXR对于胰腺炎来说是保护性的。
图1.胰腺炎患者胰腺组织中FXR的表达水平
接下来,作者在多种胰腺炎小鼠模型中给予了FXR的激动剂GW4064,结果发现GW4064能够显著地缓解小鼠胰腺炎。除此以外,作者发现,在FXRacinarΔ/Δ小鼠中,GW4064失去了对于胰腺炎的治疗作用。这些结果表明,FXR激动剂能够激活胰腺腺泡细胞中的FXR来治疗胰腺炎。
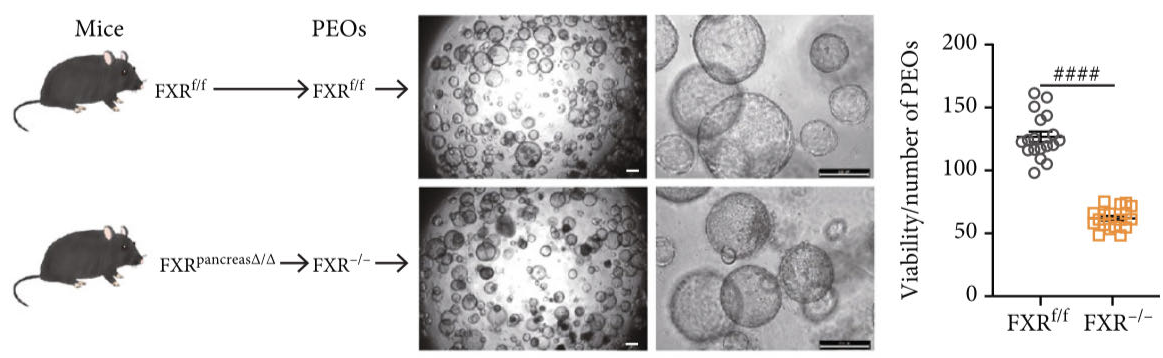
在体外,研究人员培养了野生型以及FXR敲除的小鼠胰腺外分泌类器官(PEOs)。结果表明,FXR缺失的PEOs相比于正常来讲,表现出了较低的活力与较低的抗逆性。通过RNA-seq,作者发现,FXR敲除的PEOs在面对脂肪酸应激时,炎症相关基因的升高和修复基因的降低幅度相比于野生型PEOs来说会更高。体外的这些结果表明FXR在胰腺外分泌腺中的重要保护作用。
图2.FXR敲除小鼠的胰腺类器官活力下降
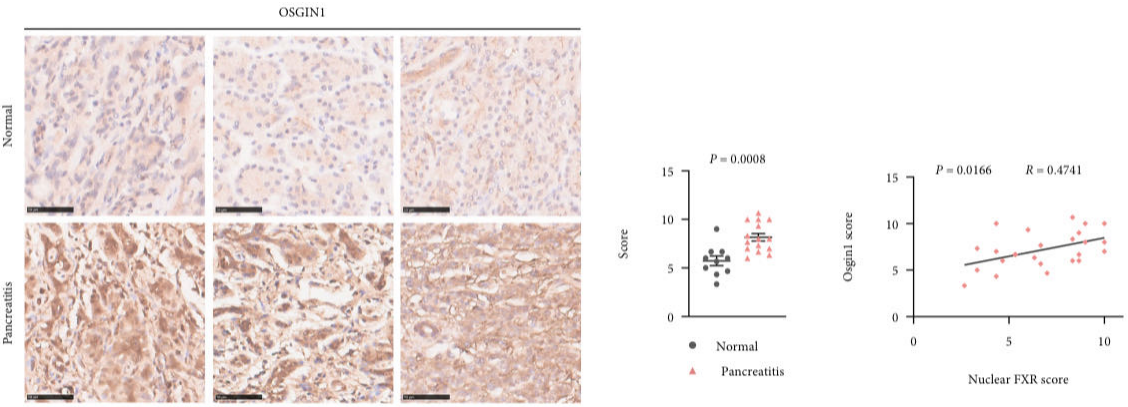
那么,FXR保护胰腺炎的分子机制是怎样的呢?作者通过对PEOs的RNA-seq和ChIP-seq发现了FXR在胰腺外分泌腺细胞中的重要下游,OSGIN1(氧化应激诱导的生长抑制因子1)。并且发现OSGIN1在胰腺炎患者的胰腺组织中也高表达,且和FXR的入核呈现显著的正相关。
为了探索FXR是否通过OSGIN1来保护胰腺炎,作者构建了OSGIN1胰腺特异性敲低和过表达的AAV病毒。结果显示,OSGIN1的敲低导致GW4064治疗作用的消失,OSGIN1的过表达能够治疗小鼠的胰腺炎。这些结果表明,OSGIN1介导了FXR对于胰腺炎的保护作用,而OSGIN1本身也可以保护胰腺炎。
最后作者探索了FXR-OSGIN1保护胰腺炎的机制。通过对OSGIN1过表达小鼠的胰腺组织进行RNA-seq,作者发现OSGIN1的过表达显著影响了自噬相关的生物学过程。通过一系列体内体外的实验,作者发现FXR的激动剂能够激活胰腺细胞中的自噬流,提升LC3II与LC3I的比值。而FXR的腺泡特异性敲除导致胰腺组织中出现了更严重的自噬障碍。
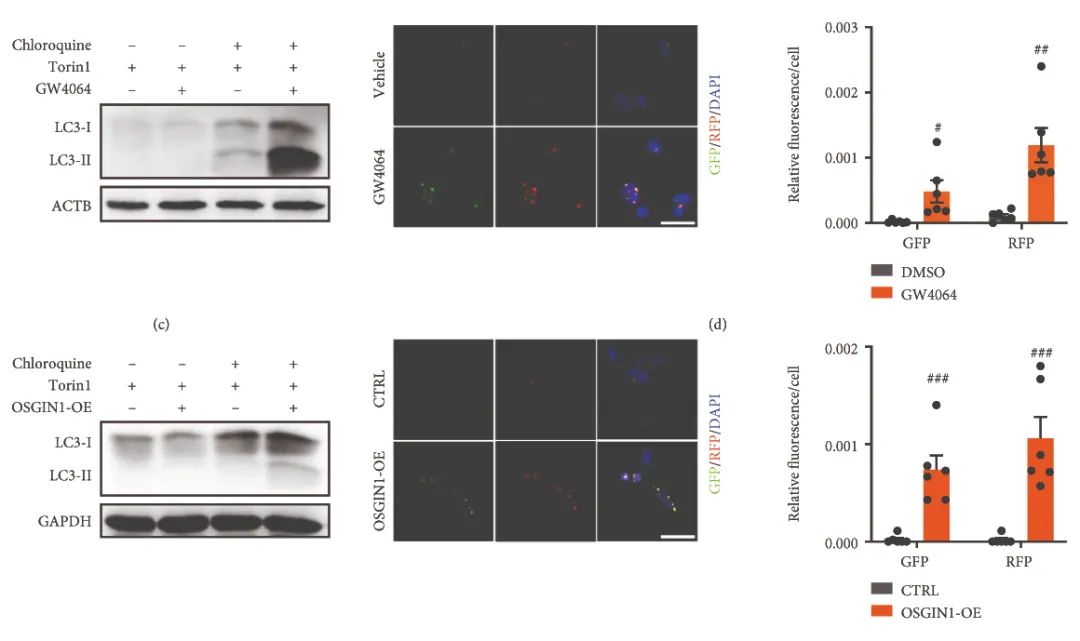
图4.FXR-OSGIN1激活胰腺细胞中的自噬流
总体来讲,研究人员发现FXR在胰腺外分泌细胞中,能够通过促进OSGIN1来恢复受损的自噬流,从而保护胰腺炎。本文揭示了FXR在胰腺炎中的分子功能及作用机制,为胰腺炎的治疗提供了新的治疗靶点。本研究中用到的OSGIN1胰腺特异性敲低和过表达的病毒均由武汉枢密科技构建。

扫码下载原文
本文第一作者为复旦大学博士研究生郑煜凡(已毕业),复旦大学八年制临床医学专业孙雯睿同学及郑州大学第一附属医院王正洋医生为本文的共同第一作者。江南大学无锡医学院副院长孙宁研究员为本文的通讯作者。复旦大学基础医学院李晓波副教授为本文的共同通讯作者。该研究得到了国家重点研发计划和中国自然科学基金的资助。
References
1.Petrov, M.S. and D. Yadav, Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol, 2019. 16(3): p. 175-184.
2.Beyer, G., et al., Chronic pancreatitis. Lancet, 2020. 396(10249): p. 499-512.
3.Forsmark, C.E., S.S. Vege, and C.M. Wilcox, Acute Pancreatitis. N Engl J Med, 2016. 375(20): p. 1972-1981.
4.Perides, G., et al., Biliary acute pancreatitis in mice is mediated by the G-protein-coupled cell surface bile acid receptor Gpbar1. Gastroenterology, 2010. 138(2): p. 715-725.
5.Kim, J.Y., et al., Transporter-mediated bile acid uptake causes Ca2+-dependent cell death in rat pancreatic acinar cells. Gastroenterology, 2002. 122(7): p. 1941-1953.
本文使用的病毒产品全部来自枢密科技,列表如下:

AAV pan血清型
胰腺是机体重要的内外分泌的功能器官,参与机体消化、血糖代谢、脂质代谢等。当其发生病变会导致糖尿病、胰腺癌的发生,因此在代谢和肿瘤研究中找到靶向胰腺的病毒载体非常重要。
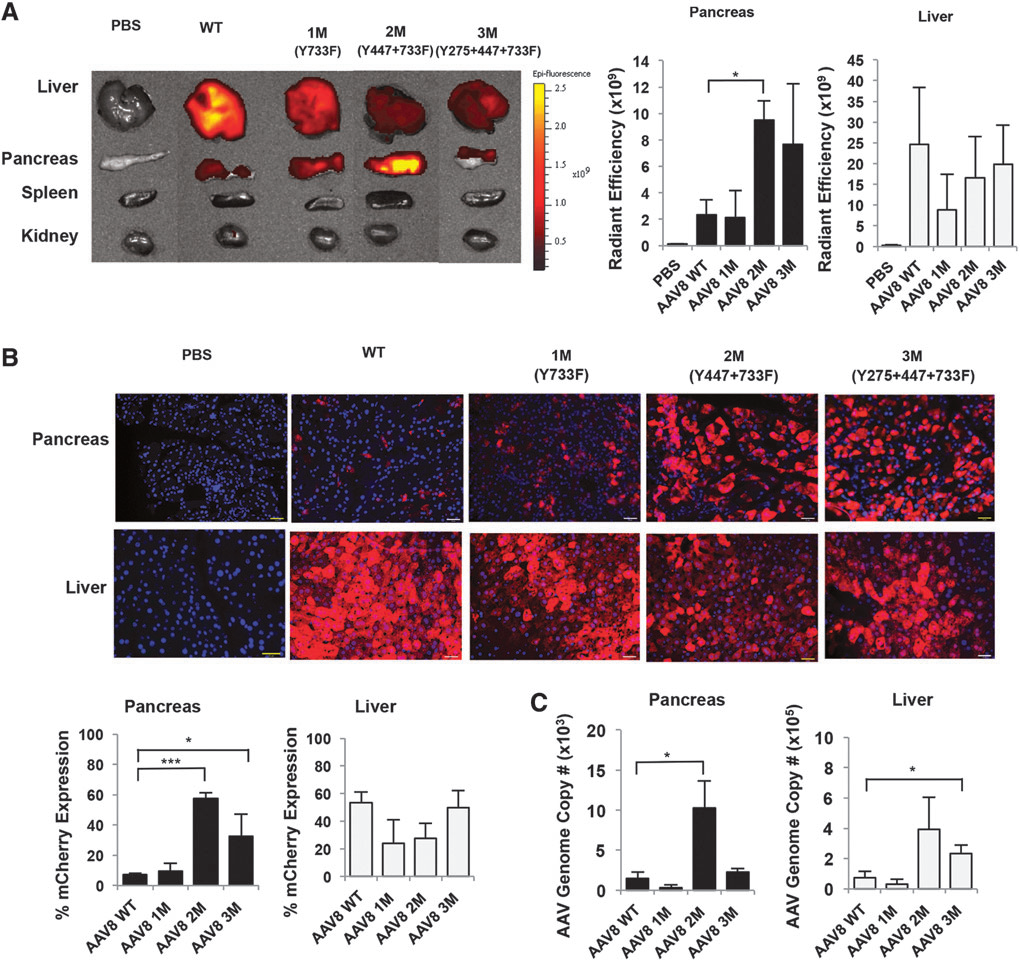
过去,为了感染胰腺,我们常用AAV8病毒载体,但是其感染过程非常复杂,需要用微夹钳夹住胆胰管的近肝端和近十二指肠端,然后用泵将病毒注入胆管感染胰腺。
但是,这些繁琐的操作除了提高了该技术的应用门槛,还导致了大量动物的损伤,甚至死亡。此外,在感染胰腺的过程中,AAV病毒颗粒在运输过程中被细胞内泛素-蛋白酶体降解,使得常规血清型的AAV载体对于这道“壁垒”显得力不从心。
2017年Maria团队对AAV8血清型的氨基酸进行了多组定点突变,最终能够高效感染胰腺的AAV8 2M(Y447+733F)血清型从众多突变体中脱颖而出。枢密科技据此,开发了高效感染胰腺的血清型AAV8 2M,命名为AAV pan,腹腔注射1E+11 vg/只即可高效转导胰腺组织(胰腺肿瘤组织中需3E+11 vg/只)。欢迎客户垂询!
(Chen M, Maeng K, Nawab A, et al. Hum Gene Ther Methods. 2017 Feb;28(1):49-59.)

了解产品及服务请扫码
或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK