2021-09-22 阅读量:706
编者按
现代神经科学研究的核心目标之一,是了解不同脑区之间的细胞特异性的连接方式以及其中详细的调节机制。在神经环路中,可以通过基因表达谱、生理学和形态学对神经元进行更细致的分群。大脑不同脑区的信息交流主要通过神经元的突触传递进行,轴突末梢的突触常常与其他神经元的树突进行连接,而神经示踪技术可以绘制这些细胞的连接方式。通常顺行示踪剂会通过顺轴浆运输移动到投射下游。而逆行示踪剂则能通过逆轴浆运输从轴突末梢移动到胞体。利用病毒传播的自然特性,越来越多的病毒被改造用于神经环路的示踪,极大的促进了大脑神经环路和特异性神经投射的网络研究。小编在这里给大家推荐Xu X等发表在《Neuron》题为“Viral Vectors for Neural Circuit Mapping and Recent Advances in Trans-synaptic Anterograde Tracers”的综述,该文介绍了用于神经环路研究的顺行示踪剂和逆行示踪剂,描述了用于神经科学研究的特定病毒载体,详细介绍了病毒载体在轴突示踪和跨突触示踪的应用进展。

1.神经环路研究的传统示踪剂
神经解剖束追踪最早由沃勒发现,在损伤的神经元轴突从病变部位向远端投射逐渐退化,随后在肌萎缩侧索硬化症和阿尔兹海默症等神经退行性疾病中均发现神经元的“沃勒样”变性。到了1960年代,化学性的示踪剂被开发出来,随后在很长一段时间作为神经示踪的主流方案。
化学性的神经示踪剂包括放射性标记的氨基酸,可以对CNS中的周围连接进行放射性的显像示踪。随后使用的2-脱氧葡萄糖在神经示踪上也显示出明显的效果。在随后的研究中,研究人员在逆行示踪剂方面开发出辣根过氧化物酶(HRP)、霍乱毒素B(CTB)、破伤风毒素和羟脒替(Fluoro-Gold)。在顺行示踪剂方向,研究人员开发出生物素化的葡聚糖胺(BDAs)、植物血凝素L(PHA-L),同时标记顺行和逆行示踪的有小麦胚芽凝集素(WGA)。
非病毒的常规示踪剂是可视化大量神经连接的有效工具,这些示踪剂通常采用注射的方式,可以在任何感兴趣的动物身上进行实验,且无需特定遗传背景的基因小鼠。但是这些方案具有明显的局限性,仅能看到神经元的全脑投射连接,不能具体细分投射的细胞类型以及突触连接方式。相比之下,病毒示踪策略可以有效的靶向特定细胞类型,并且通过修改病毒可以有效的在目标细胞内表达特定的小分子示踪剂,比如WGA。以至于现在神经科学病毒示踪技术逐渐取代化学示踪技术。
2.神经环路示踪的工具病毒
一个完整的具有传染性的病毒颗粒,由被病毒衣壳蛋白质保护层包围的核酸组成,衣壳是由病毒基因组编码的蛋白质,衣壳的不同形态是区分病毒的基础。一些病毒还有一层覆盖层,被称为包膜。病毒衣壳和包膜调节病毒的附着和与宿主细胞表面的受体相互作用,这决定了病毒的趋向性。假病毒策略就是用另一种病毒包膜或衣壳蛋白替换原病毒的包膜或衣壳蛋白,可创造出有新的趋向性和运输特性的病毒载体。
病毒通常分为单链或双链基因组DNA或RNA病毒,单链基因组由一串未配对的核苷酸组成,而双链基因组由一串互补配对的核苷酸组成。对于大多数RNA基因组病毒和一些单链DNA基因组病毒,单链根据核苷酸序列是否与病毒的信使RNA互补,分为正义链和反义链。正义链病毒RNA可直接被宿主细胞翻译,而反义链的RNA和病毒的mRNA互补,因此必须在翻译前通过病毒依赖的RNA聚合酶转化为正义链。对于DNA病毒,正义单链DNA与病毒mRNA序列相同,也是编码链。而双链DNA病毒中同时包含模板和编码链。
神经科学研究中常使用的病毒是基因改造或重组的野生型病毒株。包括腺相关病毒、腺病毒、单纯疱疹病毒、伪狂犬病毒、慢病毒和其他逆转录病毒、辛德毕斯病毒和塞姆利基森林病毒、狂犬病毒和水泡性口炎病毒、牛痘苗病毒和杆状病毒等。

Figure 1. 按病毒基因组、病毒结构、基因表达及复制模式区分的不同类型的动物病毒
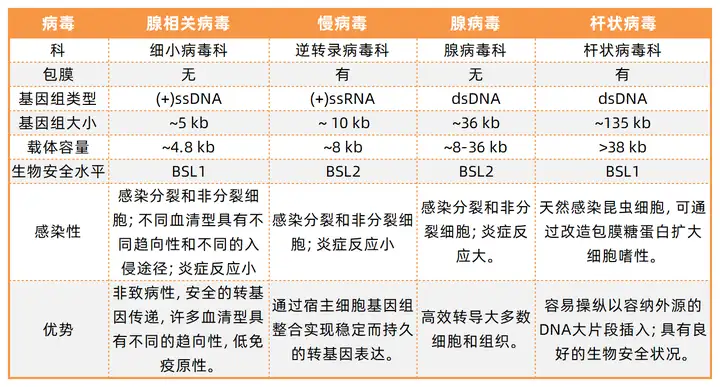
表1. 神经科学应用中基因传递常用病毒载体特性(部分)
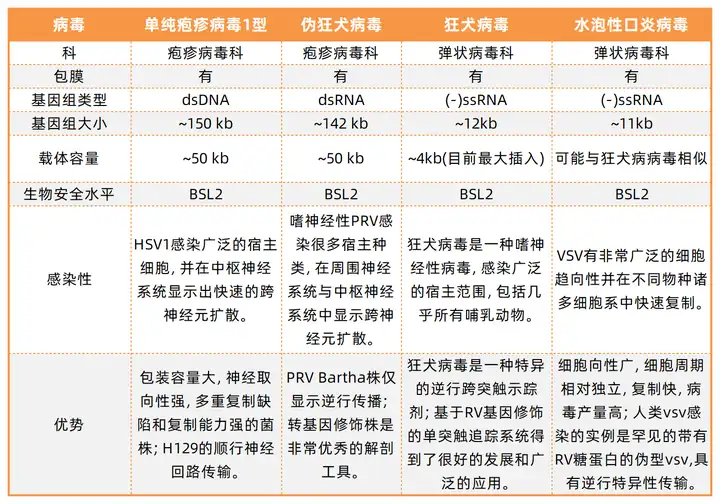
表2. 常用跨神经元/跨突触病毒示踪剂的特性(部分)
3.用于细胞标记和基因传递的病毒载体
腺相关病毒(AAV)基因组是具有约5kb大小的单链正义链DNA,是具有自然复制缺陷的无包膜病毒。重组的AAV(rAAV)因其具有较好趋向性被广泛运用于神经科学的研究。rAAV虽然插入基因容量较小,但是其可轻松修改衣壳蛋白来获得偏好转导不同细胞类型的病毒。rAAV通常与Cre/loxP和Flp重组酶技术结合。病毒滴度和衣壳受体相互作用是AAV进入细胞和转录scDNA的效率和关键决定因素。
腺病毒(AdV)双链DNA基因组在26到48Kb之间,其衍生载体在大多数哺乳动物中转导效率较高,并且不依赖宿主细胞分裂,但会引起比AAV更大的细胞毒性。最常用的病毒载体是人类的5型腺病毒(AdV5)。腺病毒载体的改进包括去除病毒复制基因和非结构基因,以降低病毒的免疫原性。AdV载体介导的基因表达较为短暂(2周到数月不等),不适合长期研究。犬2型腺病毒 (CAV2) 是神经科学常用的工具,能有效的感染轴突末端神经元并逆行到胞体。
逆转录病毒是带有两个拷贝的单链正义链RNA病毒(7-10 Kb),感染宿主后,病毒基因组RNA首先逆转录成DNA,然后整合到宿主细胞基因组中。大多数逆转录病毒不能感染非分裂的细胞,例如神经元。目前研究通常选用HIV-1作为基因表达的病毒载体,此外逆转录病毒载体也可用于谱系追踪和标记新生神经元。
慢病毒(LV)的趋向性主要来源于其包膜上的糖蛋白,水泡性口炎病毒和伪狂犬病毒的包膜糖蛋白已经被用于制作假型慢病毒载体。辛德毕斯病毒和塞姆利基森林病毒是球形包膜病毒,病毒载体大小为10-13 kb,这类病毒感染神经元会引起细胞凋亡导致脑炎。基于此类病毒开发出来的病毒载体可在中枢快速高表达。
单纯疱疹病毒(HSV)和伪狂犬病毒(PRV)属于疱疹病毒科。HSV1作为病毒载体时可装载高达50 kb的基因组DNA,是已知的最大病毒载体之一。PRV和狂犬病毒并不相同,通常PRV并不会引起灵长类动物的感染。狂犬病毒属于弹状病毒科,基因组长度从11到15 kb不等,机体感染狂犬病毒通常是致命的,但是并不会引起广泛的神经元死亡,目前狂犬病毒已经广泛运用到多物种的逆行跨突触标记。
4.病毒的顺行示踪和逆行示踪
病毒示踪剂可分为顺行示踪剂和逆行示踪剂。重组AAV(rAAV)是神经科学家进行顺行示踪标记的首选。艾伦脑库绘制了整个小鼠大脑的神经连接图,正是基于AAV载体的病毒示踪技术。rAAV还可以用来标记稀疏神经元亚区,构建少数神经元的全脑连接方式。但该技术很难判断投射下游的神经元类型。
很少有病毒载体仅表现出顺行跨突触标记的特性。野生型的HSV和PRV均具有顺行和逆行跨突触的特点。相比之下,最常用的顺行跨突触病毒是疱疹病毒H129株的HSV1,能优先进行顺行的跨突触传播。其次是VSV病毒用于顺行投射的跨突触研究。
目前顺行示踪剂的荧光标记较弱,无法描绘出神经元的细节特点。H129株的HSV1被认为是最有应用前景的顺行神经元示踪工具。H129是从病毒性脑膜炎的患者中分离出来的,在啮齿类动物和非人灵长类动物中发现均具有良好的顺行示踪效果。但是H129具有较高的细胞毒性,在进行跨多突触示踪的时候,感染H129的小鼠会在3-7天内死亡。最近开发出来的H129-G4能增强荧光表达信号,清楚地标记神经元的树突和树突棘等细节特征。

Figure 2. H129-G4进行顺行示踪标记神经元的细节特征
逆行示踪剂包括逆行转运病毒和逆行跨神经元或跨突触病毒。用于标记投射细胞类型的病毒称为逆行运输病毒。这些病毒通过轴突末梢进入神经元,通过动力蛋白逆行运输到胞体中然后被释放。逆行运输病毒包括CAV2、rAAV2-retro、狂犬病毒糖蛋白嵌合变体慢病毒、传播缺陷的G糖蛋白缺失的狂犬病毒等。AAV6在大鼠和猴脑中也具备逆行传播的能力。

Figure 3. 逆行运输病毒标记细胞类型的策略
在逆行方向从一个神经元传播到另一个神经元的病毒被称为逆行跨神经元或跨突触病毒,这些病毒通常包括狂犬病毒、VSV、HSV1和PRV。这些病毒具有穿越多突触通路的能力和强大的复制特性,因此每一次跨突触传播都会将信号放大。虽然跨突触和跨神经元经常互换使用,但是两者有不同的含义。跨突触被认为是通过突触连接来标记神经元,而跨神经元可以在没有突触接触的情况下发生。

Figure 4. 跨突触病毒标记细胞的方式
在Cre重组酶依赖的跨单突触狂犬病毒示踪方案中,利用CaMK2-cre:TVA小鼠直接将AAV-FLEX-HB病毒和狂犬病毒EnvA-SAD△G-dsRed注射到CA1区,狂犬病毒能逆行跨一级突触到CA3和Sub脑区。而使用CAV2-cre病毒示踪方案,在CA1注射CAV2-cre病毒后,在Sub注射cre依赖的单纯疱疹病毒H129(H129△TK-tdtomato),能特异性标记CA1投射到Sub的兴奋性神经元。

5.总结
病毒示踪技术对于神经环路的研究存在重要的价值。本文回顾了用于神经系统研究的病毒特性,并比较了病毒之间的优势和局限性。尽管以狂犬病毒为代表的逆行跨突触病毒示踪技术取得不错的效果,但是顺行跨突触示踪技术表现相对较差,并具有较高的细胞毒性。预计H219的顺行示踪病毒会促进神经科学研究的新发现,通过跨学科合作产生一系列具有高标记效率和低细胞毒性的顺行跨单突触H129病毒。总之,本文提供了神经科学相关病毒的入门指南和病毒示踪技术的实验指导。
图片来源:Neuron
原文链接:https://doi.org/10.1016/j.neuron.2020.07.010

扫码阅读原文

扫码添加客服
了解更多详情及报价

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK