2023-11-08 阅读量:416
脂肪组织(Adipose tissue,AT)是松散的结缔组织,主要由脂肪细胞组成。除脂肪细胞外,脂肪组织还包含细胞的基质血管部分(SVF),包括前脂肪细胞、成纤维细胞、血管内皮细胞和多种免疫细胞(巨噬细胞等)。脂肪组织的扩张或脂肪的形成是通过肥大(成熟脂肪细胞体积增大)和增生[脂肪细胞祖细胞(间充质干细胞/脂肪前体细胞)分化增加细胞数量]来实现的。在过度营养后,脂肪组织首先通过肥大而扩张。
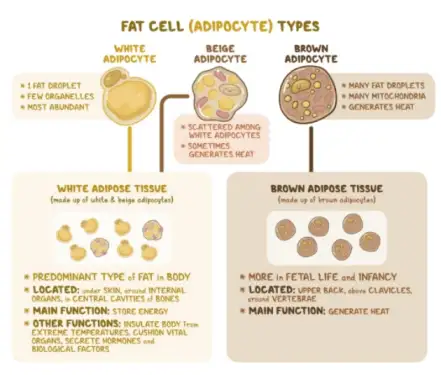
人体或者哺乳动物体内主要存在两种颜色的脂肪组织:棕色脂肪组织(brown adipose tissue,BAT)和白色脂肪组织(white adipose tissue,WAT),相应的,组成这两种组织的细胞分别为棕色脂肪细胞和白色脂肪细胞。成熟脂肪细胞根据形态和功能可以分为白色脂肪细胞、棕色脂肪细胞和米色脂肪细胞三种。白色脂肪细胞以单一的大脂滴形式储存能量,主要机能是将多余的能量以脂滴的方式储存于体内,当能量不足时释放来维持体内代谢的平衡。棕色脂肪细胞包含多个小脂滴和许多线粒体,线粒体是将脂滴转化为热量和能量的“引擎”。主要机能是通过解偶联蛋白(UCP1)来产热。米色脂肪细胞是位于白色脂肪组织中的褐色样脂肪细胞,白色脂肪细胞经过分化得到褐色脂肪细胞的特质,在某些条件下,如冷暴露和刺激特定的神经肾.上腺素受体时,有可能被激活而产生热量。
在正常体重的成人中,WAT占据15%~20%的体重,主要位于两个位置:腹腔内,称为内脏脂肪组织(visceral adipose tissue,VAT);皮下,称为皮下脂肪组织(subcutaneous adipose tissue,SCAT),也称为皮下组织,包括四肢、臀部和躯干部的皮下。VAT包裹内脏器官,保护它们免受机械摩擦和损伤,可分为肠系膜、生殖腺和腹膜后等脂肪组织,事实上,VAT是肥胖诱发心血管疾病、糖尿病等疾病的元凶;人体的脂肪大约有2/3贮存在SCAT。WAT不仅作为能量储存库,也是人体一种重要的内分泌器官,它能分泌瘦素(leptin),脂联素(adiponectin)等重要激素,在调控人体能量平衡,控制食欲,维持血糖过程中都有非常重要的作用。BAT主要分布在人体的肩胛骨间、颈背部、腋窝、纵隔及肾脏周围。体内褐色脂肪量在人的生长发育过程中是在不断发生变化的,婴幼儿期所占比例较高,随着年龄的增长,体内褐⾊脂肪量逐渐减少。成年⼈体内褐⾊脂肪的重量⼀般都低于体重的 2%。当人体受到寒冷刺激时,褐色脂肪组织燃烧⾃⾝存储的脂肪和来自白色脂肪组织的脂肪,产生大量的热以维持正常体温。
二、脂肪组织研究方向及研究方法
1.脂肪组织功能
脂肪的作用是为人体提供必要的能量和营养,脂肪、蛋白质、糖,这三类物质都可以为人体提供能量,同时三者之间也可以相互转化,其中以脂肪最为稳定,也最不容易被分解、消化,它可以作为非常好的能量储存形式,在人体必要时候可以缓慢释放,为人体提供必要的动力。
主要生理功能如下:
1、供给维持生命必需的热能;保持体温和贮存热能。
2、作为脂溶性维生素A、D、E、K等的溶剂,并促进它们的吸收。
3、给人体提供必需脂肪酸。必需脂肪酸能促进发育、维持皮肤和毛细血管的健康。
4、多数芳香物质都是脂溶性的,脂肪有利于提高食品的香气和味道,以增进食欲。
2.脂肪组织相关疾病
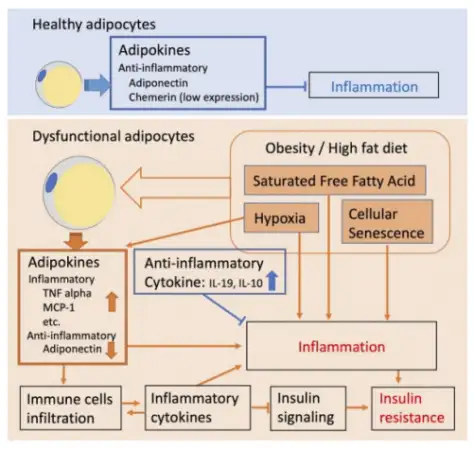
研究显示,较大的脂肪细胞是代谢功能性障碍的特征,而且脂肪细胞大小的增加与胰岛素抵抗、肝脏脂肪变性和其他代谢功能障碍标志有关。也有研究表明,肥胖与神经退行性疾病(阿尔茨海默病、帕金森病和亨廷顿病)和神经发育性疾病(自闭症、精神分裂症和脆性X综合征)有关。过度肥胖是多种疾病状态的主要风险因素,包括二型糖尿病、心血管疾病、代谢综合征、肝脏脂肪变性和癌症。瘦素-黑皮质素途径中涉及的多个基因[LEP(瘦素)、LEPR(瘦素受体)、POMC(下丘脑前阿黑皮素)、BDNF(脑源性神经营养因子)、MC4R(黑皮素受体-4)、PCSK1(前蛋白转化酶枯草溶菌素1)、SIM1(single-minded 1)和TrkB(酪氨酸激酶受体B)等]与肥胖、神经退行性和神经发育性疾病有关。2型糖尿病患者中,脂肪细胞肥大也与胰岛素抵抗和炎症有关。肥胖者的外周组织对葡萄糖的利用率明显降低,胰岛素对肝糖生成的抑制下降,游离脂肪酸增高,从而出现胰岛素抵抗,因此,肥胖是2型糖尿病的独立危险因素。
脂肪细胞是一类十分重要的内分泌细胞,能分泌几十种脂肪细胞因子及蛋白质因子,如激素敏感的脂蛋白脂酶、肿瘤坏死因子2α、纤溶酶原激活物抑制因子2、白细胞介素26、IL28、血管紧张素、胰岛素样生长因子2、瘦素、抵抗素、脂联素等,其中有些因子可能与靶细胞胰岛素受体结合,与胰岛素抵抗现象的发生具有密切关系。
3.工具病毒在脂肪中的应用
脂肪组织分布在不同的位置,包括内脏脂肪库和皮下脂肪库。每个脂肪库中独特的神经支配、血管化和细胞自主机制可能有助于不同脂肪库之间的独特功能。内脏脂肪库与代谢性疾病的风险相关。过度肥胖是公认的二型糖尿病、代谢综合征和某些类型癌症的重要危险因素。因此,通过基因操纵脂肪组织来进行功能的获得和丧失,对于研究脂肪生理学及其在疾病中的作用以及治疗方法的发展至关重要。
案例1:AAV在成年小鼠体内脂肪组织中介导的基因工程
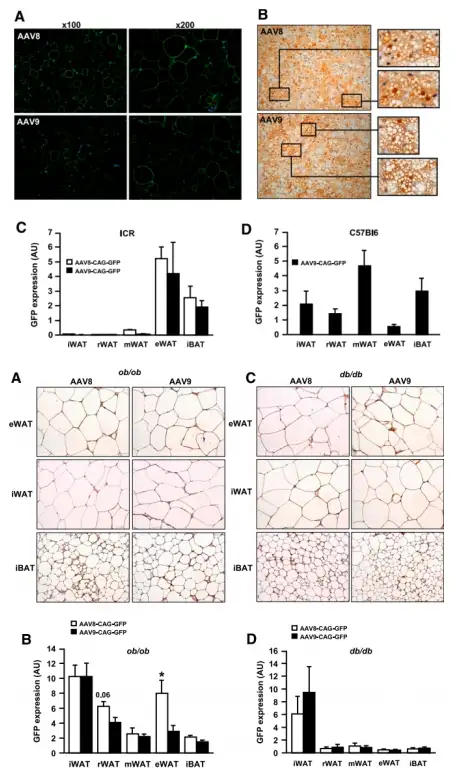
AAV8或AAV9载体的系统递送可转导多种组织。然而,以前从未报道过通过血管内注射这些血清型来转导WAT和BAT。消瘦小鼠尾静脉注射5E+12 vg的AAV8或AAV9-CAG-GFP载体,全身的白色和棕色脂肪库被转导,但不同脂肪库中的转导效率因小鼠品系而异(ICR小鼠与C57Bl/6J小鼠中不同)。重要的是,糖尿病肥胖ob/ob小鼠或db/db小鼠血管内给药AAV8或AAV9载体,也得到了消瘦小鼠中WAT、BAT类似的转导效率。
案例2:通过AAV介导棕色脂肪组织的非颤抖性产热

棕色脂肪组织(BAT)中非颤抖性产热(NST)的激活已被提出作为抗肥胖治疗。此外,冷诱导的葡萄糖摄取可以使胰岛素抵抗患者的血糖水平正常。因此,重要的是识别NST和冷诱导葡萄糖摄取的新调节因子。哺乳动物雷帕霉素靶蛋白复合物2(mTORC2)能介导代谢组织中胰岛素刺激的葡萄糖摄取,但其在NST中的作用尚不清楚。
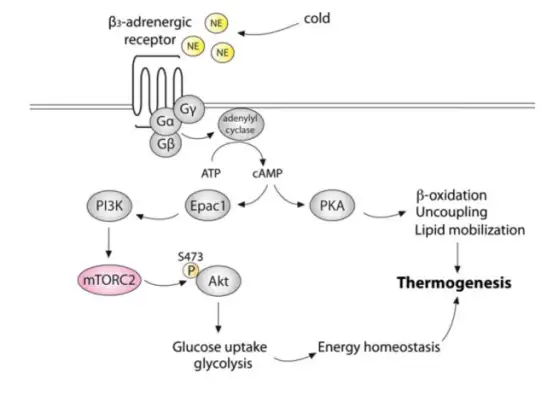
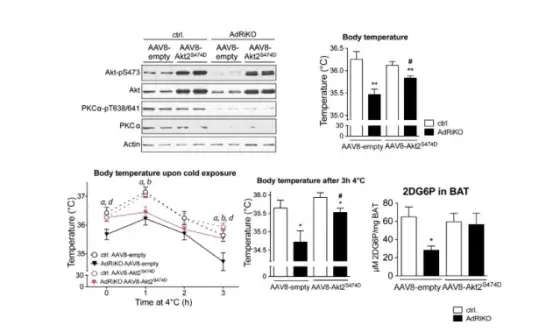
本文结果显示,在β肾.上腺素能刺激下,mTORC2在棕色脂肪细胞中被激活。此外,脂肪组织中特异性缺乏mTORC2的小鼠(脂肪组织中特异性敲除rictor的AdRiKO小鼠)体温过低,表现出对寒冷的敏感性增加,并且冷诱导的葡萄糖摄取和糖酵解受损。将AAV8-CAG-humanAkt2S474D注射到小鼠肩胛间棕色脂肪组织中(过表达活化的Akt2,2E+11 vg/只,每个脂肪小叶注射2次10 μL,使载体在整个脂肪库中分布),结果表示能恢复BAT中葡萄糖摄取,并足以提高AdRiKO小鼠的体温及改善其耐寒性。因此,表明BAT中的mTORC2-Akt(蛋白激酶B)信号介导冷诱导的葡萄糖摄取和糖酵解进而调节BAT葡萄糖代谢,从而维持非颤抖性产热(调节温度稳态)。
案例3:通过口服工程化AAV血清型载体转导棕色脂肪组织进行基因操纵

重组腺相关病毒(rAAV)载体是用于基因治疗极具吸引力的工具。与肝脏和肌肉相比,,使用天然存在的AAV血清型将基因递送到脂肪组织的成功率较低。本文研究结果显示口服工程化血清型Rec2能优先转导棕色脂肪组织,而不会转导胃肠道。在六种天然和工程化血清型中进行比较,Rec2是实现高水平转导的最有效的血清型,其剂量比报道的系统给药剂量低1~2个数量级。通过口服Rec2-VEGF载体实现棕色脂肪中血管内皮生长因子(VEGF)的过表达,增加了棕色脂肪质量并增强了产热。相反,通过Rec2-Cre载体敲低VEGFloxP小鼠棕色脂肪中的VEGF,阻碍了冷反应并降低了棕色脂肪质量。综上所述,口服Rec2载体为基因操纵棕色脂肪的研究和治疗应用提供了一种新的工具。
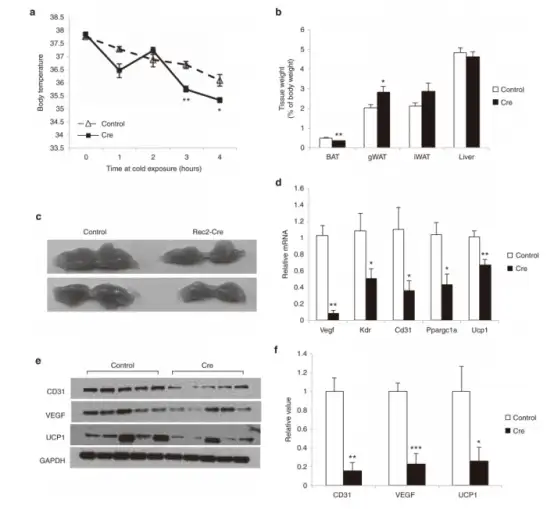
VEGFloxP小鼠口服Rec2-Cre(2E+10vg/只,200 μL)介导BAT中VEGF敲低
VEGFloxP小鼠口服Rec2-Cre 5周后,Rec2-Cre处理小鼠在4℃条件下4小时内无法适当维持体温,6周后BAT质量显著减少,性腺WAT质量显著增加。WB显示BAT中的VEGF蛋白水平降低了约80%,血管标记物CD31(血小板-内皮细胞粘附分子)和生热标记物UCP1(增温素,属于解偶联蛋白)类似地减少,qPCR显示CD31、UCP1、KDR(编码VEGF受体2)和PPARgC1a(过氧化物酶体增殖物激活受体γ辅激活因子1α,参与产热)表达下调,这与产热功能障碍一致。
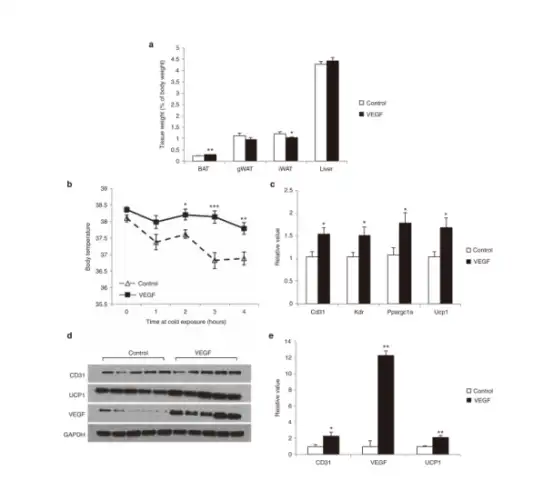
野生型小鼠口服Rec2-VEGF(2E+10 vg/只,200μL)介导BAT中VEGF的过表达
Rec2-VEGF载体导致BAT质量显著增加,皮下WAT减少,体重或食物摄入量无变化。BAT中VEGF的过度表达显著增强了冷暴露时维持体温的能力。Rec2-VEGF使BAT中的VEGF蛋白水平增加了约12倍,另外,CD31和UCP1蛋白质水平加倍。基因表达谱显示参与血管生成和产热的基因上调。
案例4:通过AAV介导的神经-脂肪回路来控制机体脂肪代谢

来自交感神经细胞和免疫细胞的信号能调节脂肪细胞,从而促进脂肪组织生物学。神经系统和免疫系统之间的相互作用最近已成为宿主防御和免疫的重要调节器。然而,目前尚不清楚神经元和免疫细胞是否在大脑-躯干轴上合作,以协调新陈代谢和肥胖。
在2021年8月份,Nature杂志发表了一篇关于神经免疫参与机体脂肪代谢的文章,揭示了神经间充质单位通过大脑-脂肪环路控制2型先天淋巴样细胞(ILC2s)、脂肪组织生理学、新陈代谢和肥胖,是首次发现的大脑通过免疫细胞调节脂肪燃烧的通路。研究人员将绿色荧光蛋白(GFP)标记的腺相关病毒(AAV)注入性腺脂肪组织(GAT)后发现,AAV感染了脂肪组织中的TH+神经元和生殖股神经的交感TH+纤维,其纵向延伸至腰大肌的腹侧,而离散的神经元胞体追踪到椎前主动脉肾神经节(ARG)和背根神经节(DRG)。随后,作者使用产生荧光蛋白的伪狂犬病病毒(PRV)进行了多突触追踪,确定了与脑干、中脑、杏仁核和下丘脑中重叠离散大脑区域的多突触连接(GAT以多突触方式连接下丘脑室旁核PVH)。作者发现,交感神经末梢通过β2-肾.上腺素能受体(ADRB2)作用于邻近的脂肪间充质细胞,以控制胶质细胞源性神经营养因子(GDNF)表达和GAT中ILC2的活性。本文研究结果确定了一个神经间充质单位,能将来自长程神经元回路的信号转化为脂肪常驻ILC2功能,从而调节宿主新陈代谢和肥胖。
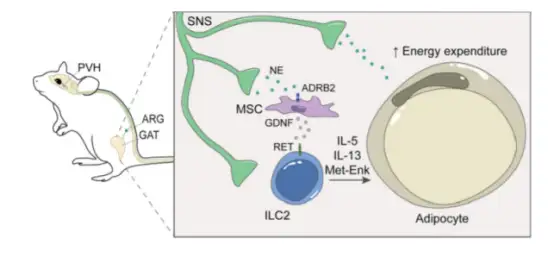
交感主动脉肾-脂肪回路连接到大脑并调节ILC2。GAT神经间充质单位将交感神经信号转化为神经营养因子表达。反过来,神经营养因子通过神经调节受体RET控制脂肪ILC2功能,调控宿主新陈代谢、能量消耗和肥胖。
AAV感染脂肪组织的方式主要通过脂肪内直接注射,也通过静脉注射,但会导致非靶向转导到肝脏或心脏组织中,通过使用特异性启动子mini/aP2或mini/UCP1来避免这一问题。而且有研究表明通过口服AAV也可感染脂肪组织。
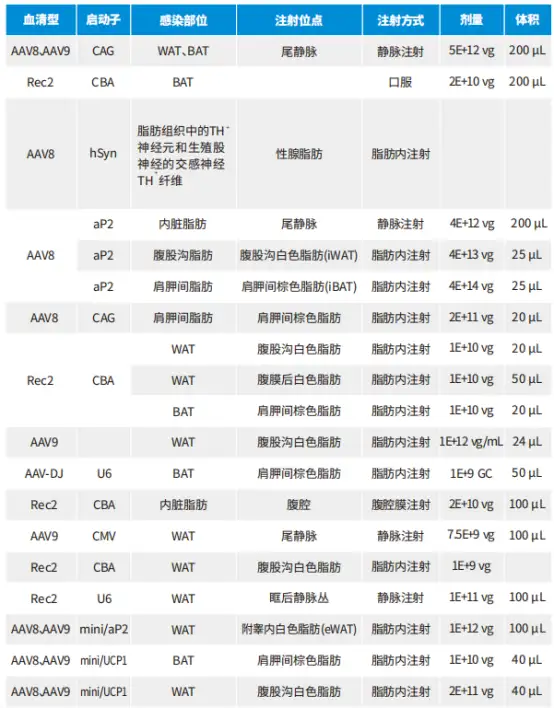
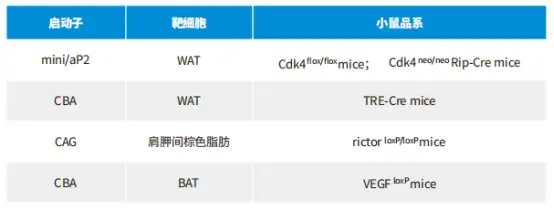
AAV感染脂肪细胞的血清型、启动子以及感染方式具体内容如下表:
[1]Jimenez V, Muñoz S, Casana E, et al. In vivo adeno-associated viral vector-mediated genetic engineering of white and brown adipose tissue in adult mice. Diabetes. 2013 Dec;62(12):4012-22. doi: 10.2337/db13-0311. Epub 2013 Sep 16. PMID: 24043756; PMCID: PMC3837045.
[2]Albert V, Svensson K, Shimobayashi M, et al. mTORC2 sustains thermogenesis via Aktinduced glucose uptake and glycolysis in brown adipose tissue. EMBO Mol Med. 2016 Mar 1;8(3):232-46.
[3]Huang W, McMurphy T, Liu X, et al. Genetic Manipulation of Brown Fat Via Oral Administration of an Engineered Recombinant Adeno-associated Viral Serotype Vector. Mol Ther. 2016 Jun;24(6):1062-1069.
[4]Cardoso F, Klein Wolterink RGJ, et al. Neuro-mesenchymal units control ILC2 and obesity via a brain-adipose circuit. Nature. 2021 Sep;597(7876):410-414

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK