2023-07-28 阅读量:398
脊髓是中枢神经的一部分,位于脊椎骨组成的椎管内,呈长圆柱状。上端与颅内的延髓相连,下端呈圆椎形。脊髓内部由中央部的灰质和周围的白质构成。灰质的轮廓呈“H”形或蝴蝶形,其伸出的突起分别称为后(背)角和前(腹)角。一般而言,位于后角内的神经元主要与感觉功能有关,而位于前角内的神经元大多与运动功能有关。脊髓的白质主要由上行(感觉)和下行(运动)有髓鞘神经纤维组成,分为前索、侧索和后索三部分。前索位于前外侧沟的内侧,主要为下行纤维束。侧索位于脊髓的侧方前外侧沟和后侧沟之间,有上行和下行传导束。后索位于后外侧沟的内侧,主要为上行传导束(本体感觉和一部分精细触觉)。
脊髓是周围神经与脑之间的通路,也是许多简单反射活动的低级中枢,其最大的任务是接受来自躯干以及四肢的感觉传入纤维,并控制躯干和四肢的各种功能。来自四肢和躯干的各种感觉冲动,通过上行纤维束传导径路将各种感觉冲动传达到脑,从而进行高级综合分析;脑的活动则是通过下行纤维束调整脊髓神经元的活动。
电信号是神经活动的最直接表现,因此电生理记录是神经信号检测的金标准。通常可以分为在体电生理和离体电生理两种。离体电生理记录多数采用膜片钳技术,通过细胞膜贴附式或全细胞记录模式记录急性取材的脊髓切片上的神经元的电生理数据,该方法已经成为研究神经回路的重要工具。这种技术要比通过细胞培养的方法测定运动神经元的电活动有明显的优势。
脊髓损伤(spinal cord injury, SCI)是脊柱损伤最严重的并发症,往往导致损伤节段以下肢体严重的功能障碍。脊髓损伤不仅会给患者本人带来身体和心理的严重伤害,还会对整个社会造成巨大的经济负担。由于脊髓损伤所导致的社会经济损失,针对脊髓损伤的预防、治疗和康复已成为当今医学界的一大课题。脊髓损伤模型的实验研究是脊髓神经再生与修复的常用技术手段,其中,对实验动物的行为学观察是常用的研究方法,但其敏感性不足,而神经电生理检测则可以提供脊髓损伤后神经功能及其康复过程中的定量、客观、高灵敏度的数据。
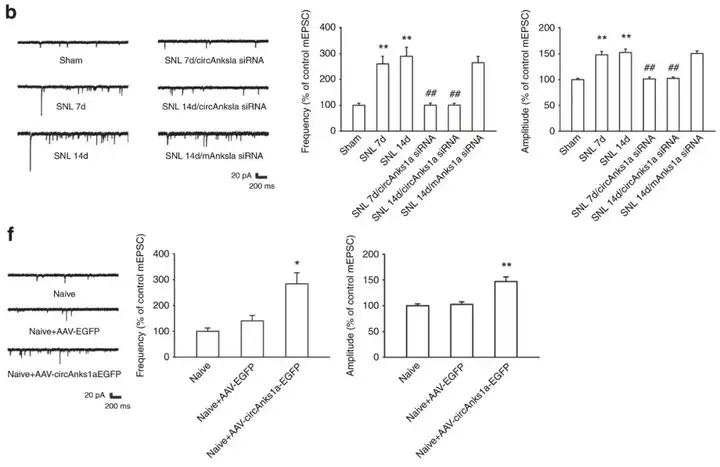
1、脊髓circAnks1a促进中枢敏化
神经损伤(SNL,脊神经结扎)后第7天(SNL 7d)、第14天(SNL 14d)脊髓切片的电生理研究表明NK1R阳性神经元(circAnks1a阳性细胞)中微小兴奋性突触后电流(mEPSC)的频率和幅度显著增加。而由于鞘内注射circAnks1a siRNA对circAncs1a的抑制作用,造成SNL 7d、14d诱导的mEPSC幅度和频率的增加减少。另一方面在naive小鼠中经椎管将AAV-hSyn-circAnks1a-nEF1α-EGFP注射到L4-L6脊髓节段以在脊髓背角过表达circAnks1a,结果显示mEPSC的幅度和频率增加。总的来说,这些结果表明脊髓circAnks1a促进中枢敏化。
图1. 电生理检测表明circAnks1a与中枢敏化有关(客户文章,Zhang SB, Lin SY, Liu M, et al. Nat Commun. 2019.)
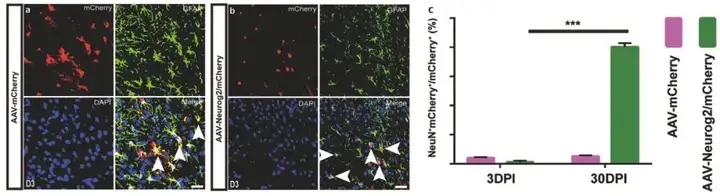
2、Neurog2直接将脊髓星形胶质细胞转化为神经元
为探究Neurog2在体内是否直接将脊髓星形胶质细胞转化为功能神经元,野生型成年小鼠脊髓背角胸8-10节段(T8-T10)分别注射对照病毒AAV-mCherry及AAV-Neurog2/mCherry,感染后3天,两种载体都靶向星形胶质细胞(mCherry与星形胶质细胞标记物GFAP共标率很高,分别为AAV-mCherry:92.29±5.26%;AAV-Neurog2/mCherry:90.31±3.19%)。此外,感染后30天AAV-Neurog2/mCherry组mCherry+细胞与神经元标志物NeuN的共定位高达80.11±5.42%,但对照组中mCherry+细胞不表达NeuN。
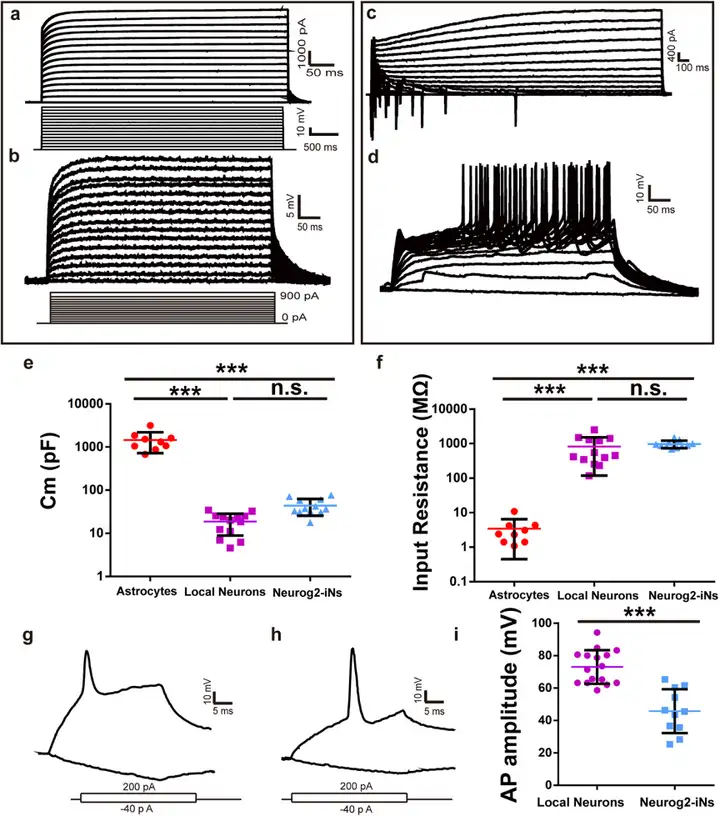
接下来,研究人员在病毒感染后30天获得的急性背侧脊髓切片中进行全细胞记录来测试iN细胞(诱导的神经元细胞,mCherry+)的功能特性。感染细胞通过mCherry的表达进行鉴定。在感染对照病毒AAV-mCherry的小鼠切片中,发现感染的细胞在电压钳模式下向胞内注射步阶电压时没有表现出内向钠离子电流(图3a)。在电流钳模式下注射步阶电流时也没有动作电位(AP)产生(图3b)。这些细胞还表现出更高的膜电容(图3e)以及相对较低的输入电阻(图3f)。而这些特性与星形胶质细胞相符。但在感染AAV-Neurog2/mCherry的小鼠切片中,电压钳模式下大多数被感染的细胞均表现出内向电流和外向电流(图3c),大多数记录的细胞(9/11)可以产生多个AP(图3d)。与局部神经元相比,Neurog2诱导的iN细胞具有相对较低的AP幅度(图3g-i),iN细胞的膜电容(图3e)和输入电阻(图3f)在很大程度上与局部神经元相当。综上所述,这些结果表明Neurog2可以在成年小鼠中将脊髓星形胶质细胞转化为功能神经元。
图2. Neurog2在小鼠体内将脊髓背侧星形胶质细胞转化为神经元(modified)
图3. Neurog2-iN细胞表现成熟电生理特性
我司脊髓切片电生理测定效果
图4. 全细胞记录脊髓背根神经节神经元电活动。(A)脊髓切片(250 µm)。(B)胶状质(SG)区神经元膜片钳记录代表图。(C)全细胞记录动作电位。(D)全细胞记录自发兴奋性突触后电流(sEPSC,上)和自发抑制性突触后电流(sIPSC,下)。
枢密科技可为大家提供脊髓切片电生理测定服务
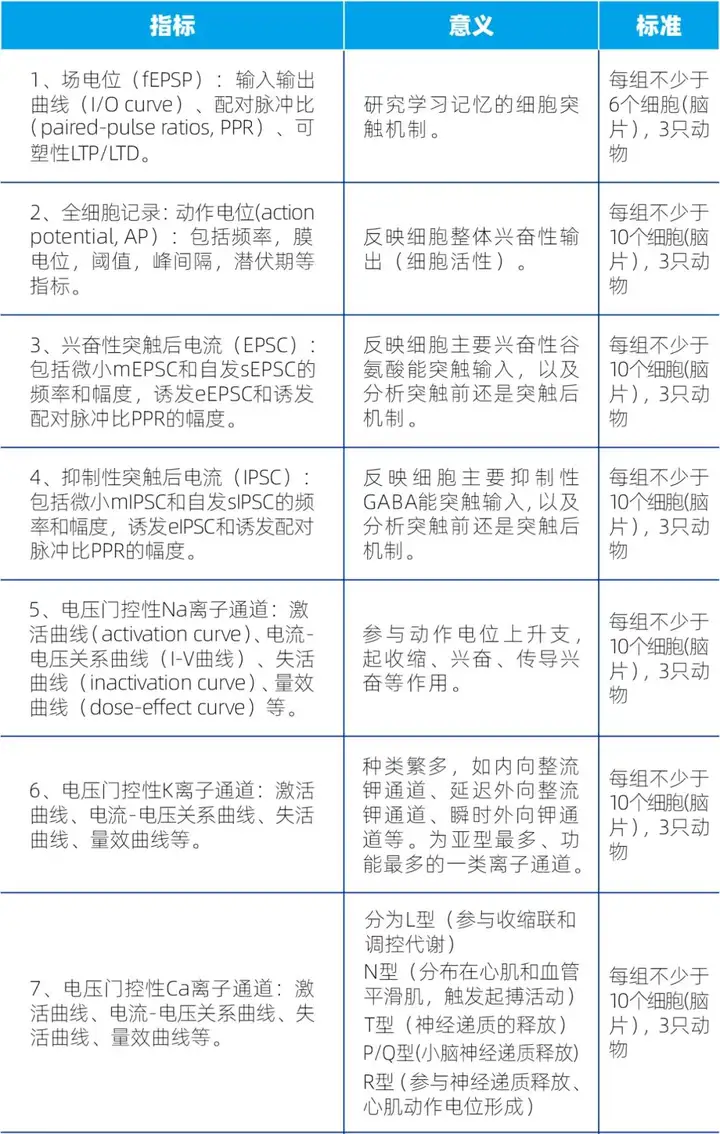
膜片钳电生理相关服务内容(部分检测项目)
参考文献
[1]Zhang SB, Lin SY, Liu M, et al. CircAnks1a in the spinal cord regulates hypersensitivity in a rodent model of neuropathic pain. Nat Commun. 2019 Sep 11;10(1):4119.
[2]Liu F, Zhang Y, Chen F, et al. Neurog2 directly converts astrocytes into functional neurons in midbrain and spinal cord. Cell Death Dis. 2021 Mar 1;12(3):225.

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK